
| R | ||
| X | Y | Z |
| A、R的气态氢化物比Y的气态氢化物稳定 |
| B、原子半径大小顺序是Z>Y>X |
| C、Y、R形成的化合物YR2能使KMnO4溶液褪色 |
| D、X、Y、Z中X的最高价氧化物对应的水化物的酸性最强 |


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
| A、含4.8g 碳元素的石墨晶体中的共价键数是0.8NA |
| B、标准状况下,11.2LCO和N2的混合气体中,含有的原子数为NA |
| C、1mol的羟基(-OH)与1mol的氢氧根离子(OH-)所含电子数均为9NA |
| D、常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反 应后的生成物分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制阿司匹林时用水洗涤产品,而在制摩尔盐时用酒精洗涤产品 |
| B、纸层析法通常把不与水混溶的有机溶剂作为固定相 |
| C、中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| D、减压过滤装置中,布氏漏斗的颈口斜面应与吸滤瓶的支管口相对,以便于吸滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.0O | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
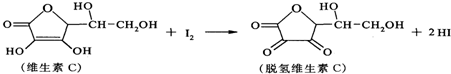
| A、上述反应为取代反应 |
| B、维生素C在酸性条件下水解只得到1种产物 |
| C、维生素C具有氧化性 |
| D、脱氢维生素C的分子式为C6H6O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 预期现象 | 结论 |
| 步骤一: | 若产生蓝色沉淀 | |
| 步骤二: | 则“猜想二”成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、选煤厂溶剂萃取脱硫 |
| B、煤的气化(产物主要为CO和H2) |
| C、将煤在氢气和催化剂作用下通过加氢裂化转变为液体燃料的过程 |
| D、发电厂用燃煤发电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com