
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
分析 (1)由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低;而根据元素周期律,同周期从左向右原子半径逐渐减小;
(2)电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,故电负性最强的物质在周期表的右上角(零族元素除外);由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低;
(3)由表中数据可知,电负性最小的元素是第六周期,第ⅠA族.
解答 解:(1)由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低,而根据元素周期律,同周期从左向右原子半径逐渐减小,所以在同周期元素中原子半径越小,元素电负性越大,故答案为:自上而下电负性降低;原子半径越小,元素电负性越大;
(2)电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,故电负性最强的物质在周期表的右上角为F元素;
由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低,故钙元素的电负性比K元素大,但小于Mg元素的电负性,即0.8<X(Ca)<1.2,
故答案为:F;0.8;1.2;
(3)由表中数据可知,电负性最小的元素是第六周期,第ⅠA族,故答案为:六;ⅠA.
点评 本题考查电负性及与金属性非金属性的关系等,难度中等,清楚主族元素电负性的递变规律是解题关键.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 不能氧化成醛 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| -C═C- | ─C≡C─ | ─CH3 | ─CH2CH3或─C2H5 |
| 双键 | 三键 | 甲基 | 乙基 |
| ─OH | -COO-R | ─CHO | ─COOH |
| 羟基 | 醛基 | 酯基 | 羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y的原子序数a>c | B. | 离子的还原性Y2-<Z- | ||
| C. | 原子最外层电子数Y<W | D. | 离子半径X+>Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
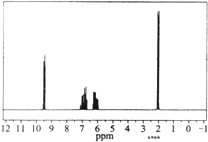
| A. | 分子中共有5种化学环境不同的氢原子 | |
| B. | 该有机物的结构简式为CH3CH=CHCOOH | |
| C. | 该物质的分子式为C4H6O | |
| D. | 该有机物不可能与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
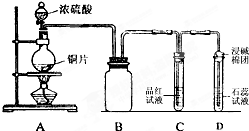 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com