
| A. | 只有①④ | B. | 只有③⑤ | C. | 只有②③ | D. | 只有①④⑤ |
分析 ①金属钠投入FeCl3溶液中,Na先与水反应生成NaOH和氢气,NaOH与氯化铁反应生成氢氧化铁沉淀;
②过量NaOH溶液和明矾溶液混合少量,铝离子转化为偏铝酸根离子;
③Ca(OH)2投入过量NaHCO3溶液中,Ca(OH)2完全反应,反应生成碳酸钙、碳酸钠和水;
④Na2O2投入FeCl3溶液中,过氧化钠与水反应生成NaOH和氧气,NaOH与氯化铁反应生成氢氧化铁沉淀;
⑤NaAlO2溶液中与足量的NaHCO3溶液混合,反应生成碳酸钠、氢氧化铝.
解答 解:①金属钠投入FeCl3溶液中,Na先与水反应生成NaOH和氢气,NaOH与氯化铁反应生成氢氧化铁沉淀,则可既有气体生成,最终又有沉淀生成,故选;
②过量NaOH溶液和明矾溶液混合少量,铝离子转化为偏铝酸根离子,则没有气体生成,也没有沉淀生成,故不选;
③Ca(OH)2投入过量NaHCO3溶液中,Ca(OH)2完全反应,反应生成碳酸钙、碳酸钠和水,则只有沉淀生成,故不选;
④Na2O2投入FeCl3溶液中,过氧化钠与水反应生成NaOH和氧气,NaOH与氯化铁反应生成氢氧化铁沉淀,则既有气体生成,最终又有沉淀生成,故选;
⑤NaAlO2溶液中与足量的NaHCO3溶液混合,反应生成碳酸钠、氢氧化铝,则只有沉淀生成,故不选;
故选A.
点评 本题考查常见金属及化合物的性质,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于白磷和红磷都是由P元素构成的且结构不同,故白磷和红磷互称为同分异构体 | |
| B. | H2O和D2O是同素异形体 | |
| C. | CH3-CH2-CH2-CH3和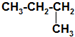 互称为同分异构体 互称为同分异构体 | |
| D. | 石英晶体是一个空间网状结构,石英晶体中不存在单个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
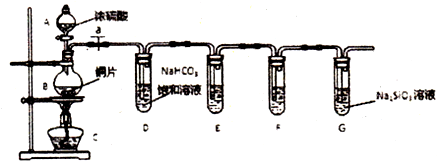
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | X | R | |
| W |
| A. | 五种元素可能都是金属元素 | |
| B. | 五种元素的原子最外层电子数一定都大于2 | |
| C. | X的氢化物的沸点一定比Z的氢化物的沸点高 | |
| D. | R的最高价氧化物对应的水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CN-和N2 | B. | NO和O2 | C. | NO2和CO2 | D. | SO2和ClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2 | B. | KNO3 | C. | NaCl | D. | (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.
X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.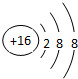 ;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.
;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
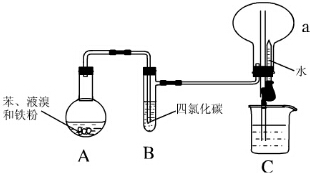 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com