
分析 非金属元素之间易形成共价键,非金属多原子分子、有机物、部分非金属氧化物等都含有共价键,活泼金属和活泼非金属元素之间易形成离子键,第IA族(H元素除外)、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,由非金属氮原子、氢原子构成的铵根离子形成的化合物属于离子化合物,含离子键、共价键,由此分析解答.
解答 解:H2S只含有H-S共价键,形成的共价化合物;MgO只含离子键形成的离子化合物,CO2是碳与氧形成的共价键,是共价化合物,NaCl只存在钠离子与氯离子之间的离子键,是离子化合物,NaOH中钠离子与氢氧根离子之间存在离子键,氢原子与氧原子之间存在共价键,是离子化合物,NaHCO3中钠离子与碳酸氢根离子之间存在离子键,碳原子与氢原子、氧原子之间存在共价键,是离子化合物,微粒间只存在共价键的是H2S、CO2;只存在离子键的是MgO、NaCl;NaOH、NaHCO3
;属于离子化合物的是MgO、NaCl NaOH、NaHCO3,属于共价化合物的是H2S、CO2,
故答案为:(1)H2S、CO2;MgO、NaCl;NaOH、NaHCO3;
(2)MgO、NaCl NaOH、NaHCO3;H2S、CO2.
点评 本题考查了化学键的判断,明确离子键和共价键的区别是解本题关键,注意离子化合物一定含有离子键,可能含有共价键,共价化合物只含共价键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
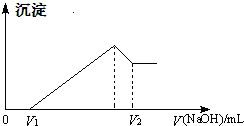 将镁、铝的混合物7.5g溶于100mL 4mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.5g溶于100mL 4mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 混合物 | 分离、提纯方法 | 选项 | 混合物 | 分离、提纯方法 |
| A | 分离苯和水 | 分液法 | B | 除去乙炔中H2S气体 | 用CuSO4溶液洗气 |
| C | 分离乙醇和甲醇 | 蒸馏法 | D | 除去水中的少量苯酚 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的正戊烷完全燃烧需要氧气分子数为4NA | |
| B. | 标准状况下,22.4L乙烷中所含电子对数目为6NA | |
| C. | 26g乙炔和苯的混合物,含有原子总数为4NA | |
| D. | 标准状况下,22.4L甲烷与氯气光照取代发生一氯取代,需要氯气0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
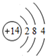 ,D在元素周期表中的位置第3周期第VIA族
,D在元素周期表中的位置第3周期第VIA族 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com