
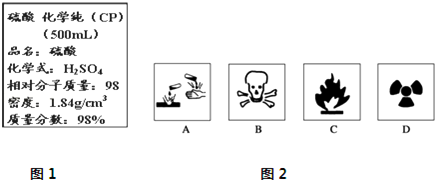
分析 Ⅰ.(1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量保持不变计算需要浓硫酸体积;
(2)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;
(3)浓硫酸具有强烈的腐蚀性;
(4)分析操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
Ⅱ.(1)浓硫酸为腐蚀品,据此选择合适的图标;
(2)根据c=$\frac{1000ρω}{M}$计算,注意硫酸的浓度越大,密度越大,以此判断浓度大小关系.
解答 Ⅰ.(1)浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量保持不变得:18.4mol/L×V=1mol/L×250mL,解得V=13.6mL;
故答案为:13.6;
(2)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般量筒量取浓硫酸,把浓硫酸倒入烧杯进行溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,配成250mL溶液,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、250mL容量瓶,所以还需要玻璃棒、胶头滴管、250mL容量瓶,
故答案为:玻璃棒、胶头滴管、250mL容量瓶;
(3)浓硫酸具有强的腐蚀性,若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 先用布擦,再用大量水冲洗、最后涂上3%~5%的NaHCO3溶液,
故答案为:先用布擦,再用大量水冲洗、最后涂上3%~5%的NaHCO3溶液;
(4)A.用量筒量取浓硫酸时俯视,导致量取的浓硫酸体积偏小,所含溶质的物质的量偏小,溶液浓度偏低,故不选;
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故选;
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,所含硫酸的物质的量偏大,溶液浓度偏高,故选;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,导致溶液体积偏大,溶液浓度偏低,故不选;
E.容量瓶不干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故不选;
F.定容时,俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故选;
故选:BEF;
Ⅱ.(1)浓硫酸具有强烈的腐蚀性,所以应标签上应印有腐蚀品标志.
故选:A;
(2)根据c=$\frac{1000ρω}{M}$计算,设98%的浓H2SO4的密度为ρ1,49%的H2SO4溶液的密度为ρ2,物质的量浓度为c,
则:$\frac{1000•ρ1•98%}{98}$=18.4,$\frac{1000•ρ2•49%}{98}$=c,因为浓硫酸浓度越大溶液密度越大,所以ρ1>ρ2,
则:c<9.2mol/L,
故答案为:<.
点评 本题考查了一定物质的量浓度溶液的配制明确配制过程是解题关键,注意容量瓶规格的选择和误差分析的方法和技巧,题目难度不大.


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 3 mol | B. | 2.4mol | C. | 2.2mol | D. | 3.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s时物质A的转化率为70% | |
| B. | 达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小 | |
| C. | 达到平衡状态时,增加A物质的量,A和B转化率都提高 | |
| D. | 当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
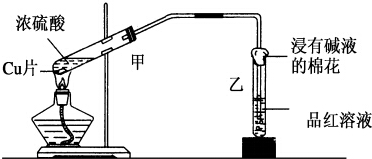 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体和其它分散系的本质区别是丁达尔效应 | |
| B. | 用四氯化碳萃取碘水中的碘单质时,上层液体呈紫红色 | |
| C. | 蒸馏时,蒸馏烧瓶加沸石是为了防止暴沸,冷凝管上口进水、下口出水 | |
| D. | 可用丁达尔效应区分溶液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 食盐水中滴加硝酸银溶液:Ag++Cl-═AgCl↓ | |
| D. | 石灰石与盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.
如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
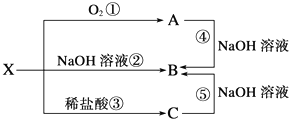
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com