
下列溶液一定呈中性的是 A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L的溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
科目:高中化学 来源: 题型:
物质丙的生产路线(反应条件略去)如下图,下列叙述错误的是
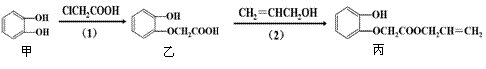 |
B.物质甲和物质丙均可与酸性KMnO4溶液发生反应
C.物质乙和物质丙均可与NaOH溶液发生反应
D.步骤(2)产物中残留的丙烯醇不可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出氯原子的原子结构示意图
(2)氯元素的非金属性 (填“强”或“弱”)于硫元素的非金属性。
(3)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱 。
(4)请写出下列物质的电子式。H2O CO2 。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下图装置可实现在铜片上镀镍,下列有关说法不正确的是

A.a为正极,d极为铜片
B.甲池是燃料电池、乙池是电镀池
C.b极上发生的电极反应为:CH4+10OH――8e-=CO32-+7H2O
D.c极上发生的电极反应为: Ni2+ + 2e-= Ni
查看答案和解析>>
科目:高中化学 来源: 题型:
【选做题】本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。
若多做,则按A小题评分。
A.[物质结构与性质]
利用反应:Cu2Cl2 +C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔。
(1)基态时亚铜离子核外电子排布式为 ▲ 。
(2)NH3中氮原子的杂化方式为 ▲ ;NH4+空间构型为 ▲ (用文字描述)。
(3)乙炔分子中σ键与π键数目之比为 ▲ ,与C22-互为等电子体的分子有 ▲ (写化学式,举一例)。
(4)氯化亚铜晶胞结构如下图,晶胞中含Cu+数目为 ▲ 。
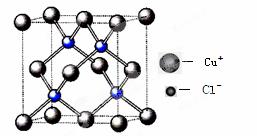
(5)合成氨工业常用铜(I)氨溶液吸收CO生成[Cu(NH3)3(CO)]+,该配离子中配体有 ▲ (写化学式)。
B.[实验化学]
已二酸是一种重要的化工中间体,可通过氧化环已醇得到。
反应原理为:

实验步骤:
步骤1.在图①所示装置的三颈瓶中加入6gKMnO4和50mL0.3mol/LNaOH溶 液,搅拌加热使之溶解。
液,搅拌加热使之溶解。
步骤2.在继续搅拌下用滴管滴加21mL环已醇,控制滴加速度,维持反应温度43~47℃。滴加完毕后, 在沸水浴中将混合物加热几分钟。
在沸水浴中将混合物加热几分钟。
步骤3.用图②所示装置趁热抽滤,二氧化锰滤渣用水洗2~3次
步骤4.滤液用小火加热蒸发浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4,冷却析出粗产品
步骤5.将粗产品用水进行重结晶提纯,然后在烘箱中烘干。

(1)写出实验仪器名称:a ▲ ; b ▲ 。
(2)步骤2在沸水浴中将混合物加热几分钟的目的是: ▲ 。
(3)步骤3趁热抽滤的目的是: ▲ ;如 何证明步骤3滤渣已洗涤干净: ▲ 。
何证明步骤3滤渣已洗涤干净: ▲ 。
(4)步骤4用盐酸酸化的目的是: ▲ 。
(5)确定最后产品成分为已二酸,还需做的实验或仪器分析有 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在水溶液中能大量共存的是
A.CH3COO-、 Cl- 、K+、 H+ B. SO42-、Cl-、Ba2+、Na+
C.Cl-、NO3-、NH4+、Na+ D.HCO3-、NO3-、Al3+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为一原电池的结构示意图,下列说法中,错误的是
A.Cu电极为正极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的应用正确的是( )
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氯气
D.氯化铝是一种电解质,可用于电解法制铝
查看答案和解析>>
科目:高中化学 来源: 题型:
废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+。用离子方程式解释其可能的原因________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为________________________________________________________________________
________________________________________________________________________。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如下:



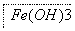


①测得滤液中c(Fe2+)为a mol·L-1,若要处理滤液,理论上需要消耗25%的H2O2溶液 68a kg(用含a的代数式表示)。2-1-c-n-j-y
②写出由Fe(OH)3制取Na2FeO4的化学方程式 2Fe(OH)3+3NaClO+4NaOH 2Na2FeO4+3NaCl+5H2O 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com