
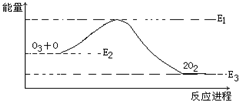
| A.反应O3+O=2O2的△H=E1-E3 |
| B.反应O3+O=2O2为放热反应 |
| C.△H=△H1-△H2 |
| D.大气层中的臭氧层无法再生 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:合肥三模 题型:问答题
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A | B | C | D | E | |
| n(CO2) | 3 | l | 0 | 1 | l |
| n(H2) | 2 | l | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | l |
| T/°C | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(Q1+Q2+Q3) kJ | B.[0.5(Q1+Q2+Q3)]kJ |
| C.(0.5Q1-1.5Q2+0.5Q3) kJ | D.(1.5Q1-0.5Q2+0.5Q3) kJ |
查看答案和解析>>
科目:高中化学 来源:平顶山二模 题型:单选题
| A.110kJ?mol-1 | B.141kJ?mol-1 |
| C.-102kJ?mol-1 | D.102kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 1 |
| 2 |
| A.Q2-Q1 | B.Q2+Q1 | C.Q1-
| D.2Q1-Q2 |
查看答案和解析>>
科目:高中化学 来源:唐山模拟 题型:问答题
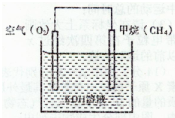
查看答案和解析>>
科目:高中化学 来源:顺义区二模 题型:单选题
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-1 068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H5++OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
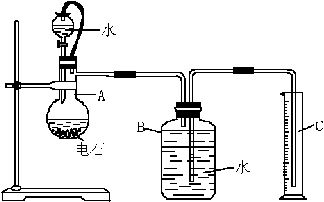
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com