
| A. | 化学反应中,反应物总能量与生成物总能量 | |
| B. | 化学反应中,反应物总质量与生成物总质量 | |
| C. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| D. | 在化合物中,正化合价总数与负化合价总数 |
分析 A.化学反应中,反应物总能量与生成物总能量一定不相等;
B.化学反应中,遵循质量守恒定律;
C.溶液稀释过程中只是增加了溶剂的量,溶质的质量并不发生改变;
D.化合物整体呈现电中性.
解答 解:A.化学反应中,反应物总能量与生成物总能量一定不相等,故A错误;
B.化学反应中,遵循质量守恒定律,反应物总质量与生成物总质量相等,故B正确;
C.溶液稀释过程中只是增加了溶剂的量,溶质的质量并不发生改变,故C正确;
D.化合物整体呈现电中性,正化合价总数与负化合价总数相等,故D正确;
故选A.
点评 本题考查了质量守恒定律和化学反应中的能量变化规律,难度不大,注意物质发生化学反应一定都伴随着能量变化和物质变化,反应物总能量与生成物总能量一定不相等.


科目:高中化学 来源: 题型:选择题
| A. | 被氧化和被还原的元素分别为铜和氮 | |
| B. | 当产生0.2mol气体时,转移电子为0.6mol | |
| C. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ | |
| D. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
| A. | I2,H2O2,KMnO4,NaBiO3 | B. | H2O2,I2,NaBiO3,KMnO4 | ||
| C. | NaBiO3,KMnO4,H2O2,I2 | D. | KMnO4,NaBiO3,I2,H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 电流由O2所在的铂电极流出 | |
| B. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| C. | O2所在的铂电极处发生还原反应 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
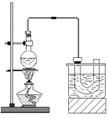 实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:
实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com