
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题:
A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)以下分别是哪种元素(用元素符号填空):
A:_____________;C:_____________;D:____________;
(2)B原子的核外电子排布式_____________;写出A的负一价阴离子的电子式_____________。
(3)E的原子结构示意图_____________。
(4)写出由A、C两元素形成的18e-分子的形成过程:_____________
【答案】H O K 1s22s22p63s23p5 〔:H〕- ![]() 2H·+2
2H·+2![]() →
→![]()
【解析】
由条件不难推出A为H元素;由条件“B原子的3p轨道上得到一个电子后不能再容纳外来电子”可知,B原子3p轨道上有5个电子,所以B为Cl元素;由条件“C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他原子的自旋方向相反”结合洪特规则和泡利不相容原理分析可知,C原子2p轨道上有4个电子,所以C元素为O元素;由条件不难推出D元素即为K元素;由E原子的价电子排布式可知,E元素为Ar元素。
(1)通过分析可知,A为H元素,C为O元素,D为K元素;
(2)通过分析可知,B为Cl元素,所以核外电子排布式为1s22s22p63s23p5;A为H元素,所以负一价阴离子的电子式为:![]() ;
;
(3)E为Ar元素,所以,原子结构示意图即为![]() ;
;
(4)A为H,C为O,形成的18e-分子即为H2O2,所以形成过程为:
2H·+2![]() →
→![]() 。
。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】摩拜单车可利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C![]() Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
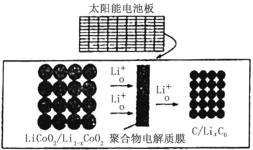
A.充电时,阴极质量增加,发生还原反应
B.充电时,电路中每有1mol电子转移,则有1molLi+由左向右通过聚合物电解质膜
C.该锂离子电池工作时,化学能转化为电能
D.放电时,正极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X能发生如图转化(四种物质均含元素R),回答下列问题:

I.已知常温下Z为一种淡黄色固体,A的水溶液能与铝反应产生氢气,则:
(1)单质X的化学式为_________,工业上Z可以用于____________。(任写一种用途)
(2)A的水溶液与铝反应的离子方程式为_______________________________。
II.若X为一种常见金属单质,白色物质A在空气中易转化为红褐色。则:
(1)Z加入酸性KMnO4溶液中,溶液由紫色褪至无色,说明Z具有________性(填“氧化”、“还原”或“漂白”)。
(2)实验室制备A常会变质,检验其可能变质的方法是将其溶于足量的稀硫酸,然后加入试剂___________,为了较长时间观察A的颜色,可采取的措施有____________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。 请回答该实验中的问题。
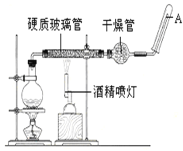
(1)写出该反应的化学方程式____________________。圆底烧瓶中盛装水,烧瓶里应事先放置____,其作用是_____。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;②取少量溶液B滴加KSCN溶液,溶液未变红色,该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到________________________________________ 的现象,请写出与上述现象相关的反应的化学方程式___________________________ ,____________________________________。
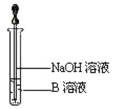
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知Al(OH)3是两性氢氧化物,但不溶于弱碱溶液氨水,也不溶于弱酸碳酸。试用离子方程式说明原理:_____、_____。
(2)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子均满足8电子稳定结构。写出(CN)2的电子式_____。
(3)请在下图的虚线框中补充完成SiO2晶体的结构模型示意图____,(部分原子已画出),并进行必要的标注。
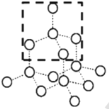
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。
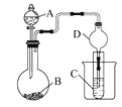
(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙醇、乙酸都可以看成是乙烷分子中的氢原子被羟基或羧基取代后的产物
B.下列分子式C2H6O、CF2Cl2、C2H4O2均可表示一种纯净物
C.C4H9OH属于醇的同分异构体的数目与C5H10O2属于羧酸的同分异构体的数目相同
D.有机物![]() 和
和![]() 的一溴取代物的同分异构体数目相同
的一溴取代物的同分异构体数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() ,
,![]() 。若在500℃和催化剂的作用下,反应在容积固定的密闭容器中进行,下列有关说法正确的是
。若在500℃和催化剂的作用下,反应在容积固定的密闭容器中进行,下列有关说法正确的是
A.达到平衡时,![]() 和
和![]() 的浓度一定相等
的浓度一定相等
B.反应体系中,当混合物的密度保持不变,反应达到平衡
C.使用催化剂、增大压强和升高温度均有利于加快反应速率
D.投入![]() 和
和![]() ,达平衡时反应放出热量为198.0 kJ
,达平衡时反应放出热量为198.0 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mLbmol/L的AlCl3溶液中加入50mLamol/L的NaOH溶液。
(1)当a、b关系不同时,反应所生成沉淀的质量不同。填写下表:___
a与b的关系 | 生成沉淀的质量(g) |
(2)若b=1mol/L时,要生成沉淀3.12g,则a值等于多少___?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com