
埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速度最慢的是()
A. 在含铁元素较多的酸性土壤中
B. 在潮湿疏松透气的土壤中
C. 在干燥致密不透气的土壤中
D. 在含碳粒较多、潮湿透气的土壤中
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
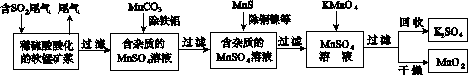
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原因是________________________________。
(3)已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ/mol
S(s)+O2(g)===SO2(g) ΔH=-297 kJ/mol
Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1065 kJ/mol
SO2与MnO2反应生成无水MnSO4的热化方程式是____________________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________________。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O ,反应结束后锌没有剩余,则反应中被还原的硝酸与未被还原的硝酸的物质的量之比为 ( )
A.1:4 B.1:5 C.2:3 D.2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列现象中硫酸所表现出来的性质填写在空白处
(1)把锌粒放入稀硫酸中时,有气体放出。
(2)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加。
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑。
(4)木炭放入热的浓硫酸中时,有气体放出。
(5)常温下可以用铁或铝的容器贮存浓硫酸
(6)热的浓硫酸与铜片等金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解精炼铜的叙述中不正确的是()
A. 粗铜板:阳极
B. 电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e﹣═Cu
C. 粗铜中所含Na、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
D. 电解铜的纯度可达99.95%﹣99.98%
查看答案和解析>>
科目:高中化学 来源: 题型:
含Cr2O72﹣的工业酸性废水会造成铬污染,排放前要进行如下处理:(Ⅰ)往工业废水中加入适量的NaCl搅拌均匀;(Ⅱ)以Fe做两电极进行电解,从而使溶液的pH不断升高,废水由酸性转化为碱性,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生:(Ⅲ)过滤回收沉淀,废水达到排放标准.
(1)在电解过程中,溶液pH不断升高的原因可能是
①电解时废水的体积不断减小 ②电解时H+在阴极被还原 ③作为阳极的Fe不断溶解 ④Cr2O72﹣转化为Cr3+时消耗了H+ ⑤NaCl在电解时转化成了NaOH
A.⑤B.②④C.②③④D.①②③④
(2)两极发生反应的电极反应式为
阳极: ;阴极: .
(3)写出Cr2O72﹣变成Cr3+的离子方程式 .
(4) (填“能”或“不能”)改用石墨电极进行电解.
查看答案和解析>>
科目:高中化学 来源: 题型:
关于0.1 mol·L-1Na2CO3溶液的叙述中错误的是 ( )
A.0.5 L该溶液中钠离子的物质的量浓度为0.2 mol·L-1
B.1 L该溶液中含有Na2CO3的质量为10.6 g
C.从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为
0.01 mol·L-1
D.取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是 (填序号),理由是 该反应既 .
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(l)+8H2O(l)△H>0
C.CaC2(s)+2H2O(l)═Ca(OH)2(s)+C2H2(g)△H<0
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H<0
(2)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为饱和的NaCl溶液,则电解时,检验Y电极反应产物的方法是 .
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中可观察到的现象为 .
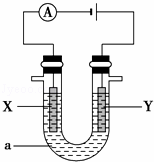
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com