
| A、在含有大量AlO2-的溶液中,NH4+、Na+、Cl-、H+可能大量共存的离子 |
| B、25℃水电离出的c(H+)=10-13mol/L的溶液中,Ba2+、I-、NO3-、Cl-一定能大量共存 |
| C、Fe(OH)3溶于HBr溶液的离子方程式:2Fe(OH)3+6H++2Br-=2Fe2++Br2+6H2O |
| D、少量的CO2通入苯酚钠溶液中离子方程式:C6H5O-+CO2+H2O=C6H5OH+HCO3- |


科目:高中化学 来源: 题型:

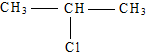 制备丙三醇最合理的步骤是( )
制备丙三醇最合理的步骤是( )| A、取代-取代-取代-水解 |
| B、消去-加成-取代-水解 |
| C、水解-取代-取代-水解 |
| D、消去-取代-加成-取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯乙烯分子中所有原子可能在一个平面上 |
| B、分子式为C7H8O且分子中有苯环的有机物共有4种 |
| C、甲醛分子中有醛基,因此无法区别甲醛溶液和甲酸溶液 |
| D、除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C12、SO2均能使滴有酚酞的NaOH溶液褪色,说明二者均有漂白性 |
| B、“水滴石穿”是因为溶解了CO2的雨水与CaCO3作用生成Ca(HCO3)2 |
| C、CuSO4?5H2O遇浓硫酸颜色变白,说明浓硫酸具有脱水性 |
| D、溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
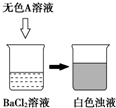 2013年刘谦第四次登上了春晚的舞台,他的魔术表演再次激起了人们强烈的好奇心,并在全国范围内掀起了魔术表演的热潮.小明同学在一次化学晚会上表演了一“‘清水’变‘牛奶’”的魔术(如图所示),下列关于该魔术的原理叙述不正确的是( )
2013年刘谦第四次登上了春晚的舞台,他的魔术表演再次激起了人们强烈的好奇心,并在全国范围内掀起了魔术表演的热潮.小明同学在一次化学晚会上表演了一“‘清水’变‘牛奶’”的魔术(如图所示),下列关于该魔术的原理叙述不正确的是( )| A、无色A溶液可能是AgNO3溶液 |
| B、无色A溶液可能是NaOH溶液 |
| C、白色浊液的分散质可能是BaCO3 |
| D、如A为硫酸,则反应不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Fe2+、Clˉ、SO42ˉ |
| B、Na+、K+、SO42ˉ、Clˉ |
| C、K+、Na+、HCO3ˉ、NO3ˉ |
| D、K+、Clˉ、Al3+、CO32ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、反应中,N2是还原剂,Al2O3是氧化剂 |
| B、反应中,每生成2 mol AlN,N2得到3 mol电子 |
| C、氮化铝中氮元素的化合价为-3 |
| D、AlN的摩尔质量为41 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应①中Se是氧化产物,I2是还原产物 |
| B、反应②中浓H2SO4是氧化剂,SeO2是还原产物 |
| C、反应①中每有1.0mol I2生成,转移电子数目为4NA |
| D、SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com