
 如图表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液.
如图表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液.

科目:高中化学 来源: 题型:
| A、①②⑤ | B、④⑤⑥ |
| C、①③④ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 仪器 |  |
 |
 |
 |
| 名称 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
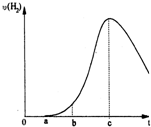 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图坐标曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图坐标曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
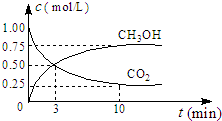 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
| ||
| ||
| ||
| 太阳光 |
| 高温 |
| n(CH3OH) |
| (CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、HCOOH分子中既有极性键,又有非极性键 |
| B、反应中,CO2被氧化,O2是还原产物 |
| C、反应中,每转移4×6.02×1023个电子,生成2.24L气体 |
| D、该过程是将太阳能转化为化学能的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com