
【题目】下列说法正确的是( )
选项 | 实验目的 | 所选主要仪器 | 部分操作 |
A | 用浓硫酸配制480mL0.1molL-1硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸倒入容量瓶中,加水溶解至刻度线 |
B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、球形冷凝管、锥形瓶、牛角管 | 控制温度分别收集甲醇和甘油 |
D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法错误的是

A. 单核阴离子的还原性Y强于X
B. W的气态氢化物与其最高价含氧酸反应生成离子化合物
C. X、Y、Z最简单氢化物中稳定性最弱的是Y
D. 在元素周期表中118号元素与Z位于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
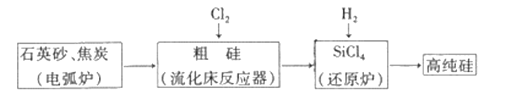
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
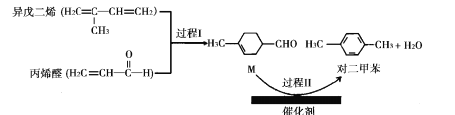
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种D.M能发生取代,加成,加聚和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学实验的叙述正确的是( )
A.配制1molL-1的硫酸铜溶液200mL,需要称取胆矾晶体40g
B.蒸馏实验中,冷凝管中冷却水应从下口通入,从上口放出
C.欲除去Fe粉中混有的I2,可加热使I2升华
D.检验溶液中是否含有Fe2+的方法是:向溶液中滴加KSCN溶液无明显现象,再向溶液中加入适量双氧水发现有血红色沉淀生成,则说明原溶液中存在Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:

(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】那可汀是—种药物,该药适用于剌激性干咳病人服用,无成瘾性。化合物I是制备该药物的重要中间体,合成路线如下:
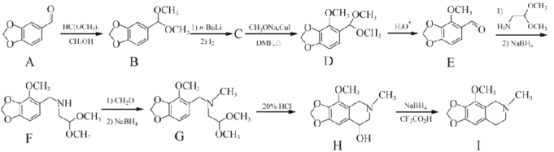
(1)化合物A中的官能团名称为____________(写两种)。
(2)I的分子式为____________。
(3)设计反应A-B的目的为____________。
(4)化合物C的分子式为C10H11O4I,写出C的结构简式:____________。
(5)化合物I的—种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________。
①分子中含有硝基(—NO2)且直接连在苯环上;②分子中只有3种不同化学环境的氢。
(6)写出以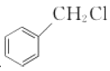 和
和 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,向20mL
,向20mL![]() 的
的![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液
的NaOH溶液![]() 滴定过程中溶液温度保持不变
滴定过程中溶液温度保持不变![]() ,滴定曲线如图1,含磷物种浓度所占分数
,滴定曲线如图1,含磷物种浓度所占分数![]() 随pH变化关系如图2,则下列说法不正确的是
随pH变化关系如图2,则下列说法不正确的是![]()
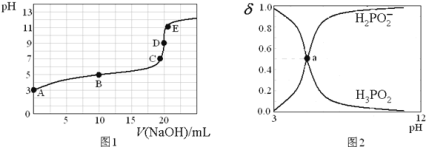
A.![]() 的电离方程式为:
的电离方程式为:![]() ;电离常数
;电离常数![]()
B.B点溶液中存在关系:![]()
C.图2中的a点对应为图1中的B点
D.D点时,溶液中微粒浓度大小关系为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下:

已知P4与两种碱的反应主要有:
Ⅰ. 2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑ Ⅱ. 4NaOH + P4+8H2O = 4NaH2PO2·H2O+2H2↑
Ⅲ. 4NaOH + P4+2H2O = 2Na2HPO3 +2PH3↑ Ⅳ. NaH2PO2+NaOH = Na2HPO3+H2↑
(1) 已知H3PO2是一元中强酸,NaH2PO2是___________(填“正盐”或“酸式盐”)。
(2)尾气中的PH3被NaClO溶液吸收可生成NaH2PO2,从吸收液中获得NaH2PO2·H2O的操作为______________、______________过滤、洗涤和干燥。
(3) 用NiCl2、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为:______________________。
(4) “反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比[n(碱)/ n(磷)]与NaH2PO2产率的关系如图所示。当n(碱)/ n(磷)>2.6时,NaH2PO2的产率随n(碱)/ n(磷)的增大而降低的可能原因是______。

(5) 滤渣2主要成分为___________________ (填化学式)。
(6) “过滤2”的滤液须用Ag2SO4、Ba(OH) 2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是_________________。
(7)在工业上,可以用惰性电极电解NaH2PO2溶液制取磷酸,请写出其阳极反应式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com