
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算其物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,摩尔质量在数值上等于其相对分子质量;
(2)n(HxR)=$\frac{5.1g}{34g/mol}$=0.15mol,而200mL 0.75mol•L-1的CuCl2溶液中氯化铜的物质的量为:0.2L×0.75mol•L-1=0.15mol,二者等物质的量反应,则HxR+CuCl2═CuR↓+2HCl,由氢元素和氯元素质量守恒可知x=2,Ar(R)=32,故R的质量数为32,由此分析解答.
解答 解:(1)标况下,Vm=22.4L/mol,n=$\frac{V}{{V}_{m}}$=$\frac{5.6L}{22.4L/mol}$=0.25mol;M=$\frac{m}{n}$=$\frac{8.5g}{0.25mol}$=34g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为34.
答:H2R的相对分子质量为34;
(2)n(HxR)=$\frac{5.1g}{34g/mol}$=0.15mol,而200mL 0.75mol•L-1的CuCl2溶液中氯化铜的物质的量为:0.2L×0.75mol•L-1=0.15mol,二者等物质的量反应,则HxR+CuCl2═CuR↓+2HCl,由氢元素和氯元素质量守恒可知x=2,Ar(R)=32,故R的质量数为32,故R的质量数为32,R的质子数和中子数均为16,R为硫元素,答:x为2,R为硫元素.
点评 本题考查了摩尔质量、质子数与中子数、质量数之间的关系等知识点,难度不大,明确各物理量之间的关系是解答本题的关键.


科目:高中化学 来源: 题型:选择题
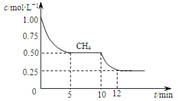 已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol
已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol| A. | △H3=+206kJ/mol | |
| B. | 反应③进行到10min时,改变的外界条件可能是升高温度 | |
| C. | 反应③进行过程中,0~5min这段时间共吸收的热量为103.05kJ | |
| D. | 当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示在恒容密闭容器中,恒温条件下发生的可逆反应2NO2(g)?N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| B. | 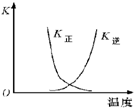 曲线表示反应2A(g)+B(g)?2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. |  表示对反应2X(g)+Y(g)?Z(s)+3W(g)△H<0 在t1时刻增大压强 | |
| D. | 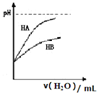 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y均为石墨电极,电解硝酸银溶液,实验装置如图所示,电解实验过程中,发现Y极增重的同时,Y极负极产生气泡且气泡由无色变红棕色.已知电流效率等于生成目标产物消耗电子书与电路转移总电子数之比.下列推断正确的是( )
X、Y均为石墨电极,电解硝酸银溶液,实验装置如图所示,电解实验过程中,发现Y极增重的同时,Y极负极产生气泡且气泡由无色变红棕色.已知电流效率等于生成目标产物消耗电子书与电路转移总电子数之比.下列推断正确的是( )| A. | Y极附近产生的无色气泡是H2 | |
| B. | X极附近电解质溶液中c(H+)会减小 | |
| C. | 若产生2.24L O2(标准状况下)时析出32.4g银,则电流效率为80% | |
| D. | 阴极的副反应为NO3-+3e-+4H+═NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:C->A->B->D- | ||
| C. | 2A-+D2═2D-+A2的反应能进行 | D. | 2C-+B2═2B-+C2的反应不能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝:治疗胃酸过多的一种药剂 | |
| B. | 明矾:净水剂 | |
| C. | 烧碱:治疗胃酸过多的一种药剂 | |
| D. | 小苏打:发酵粉主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取是常用的有机物提纯方法 | |
| B. | 燃烧法是研究确定有机物成分的有效方法之一 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 核磁共振氢谱通常用于分析有机物的相对分子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com