
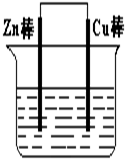
 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置.试回答下列问题:

科目:高中化学 来源:物理教研室 题型:021
A.正极附近c(![]() )逐渐增大
)逐渐增大
B.负极附近c(![]() )逐渐增大
)逐渐增大
C.正、负极附近c(![]() )基本不变
)基本不变
D.Zn片、Cu片同时有气泡冒出,则说明Zn片不纯
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
将Zn片和Cu片用导线连接置于同一稀硫酸溶液中,下列各叙述中正确的是
[ ]
A.正极附近,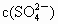 逐渐增大
逐渐增大
B.负极附近,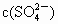 逐渐增大
逐渐增大
C.正、负极附近,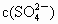 基本不变
基本不变
D.Zn片、Cu片同时有气泡冒出时说明Zn片不纯
查看答案和解析>>
科目:高中化学 来源: 题型:013
将Zn片和Cu片用导线连接置于同一稀硫酸溶液中,下列各叙述中正确的是
[ ]
A.正极附近, 逐渐增大
逐渐增大
B.负极附近, 逐渐增大
逐渐增大
C.正、负极附近, 基本不变
基本不变
D.Zn片、Cu片同时有气泡冒出时说明Zn片不纯
查看答案和解析>>
科目:高中化学 来源: 题型:
A.正极附近c(![]() )逐渐增大
)逐渐增大
B.负极附近c(![]() )逐渐增大
)逐渐增大
C.正、负极附近c(![]() )基本不变
)基本不变
D.Zn片、Cu片同时有气泡冒出,则说明Zn片不纯
查看答案和解析>>
科目:高中化学 来源: 题型:
将Zn片和Cu片用导线连接置于稀H2SO4溶液中,下列各种说法正确的是 ( )
A、电子由正极流向负极 B、溶液的PH逐渐增大
C、Zn片的质量逐渐增大 D、Zn片和Cu片上同时有气泡放出,则说明Zn片不纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com