
| A. | 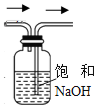 装置可用于除去NO气体中的NO2杂质 | |
| B. |  向图装置的溶液中滴入KSCN溶液不变红色,可以说明铁还没有发生吸氧腐蚀 | |
| C. | 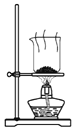 装置用于灼烧碎海带以证明海带中存在I- | |
| D. | 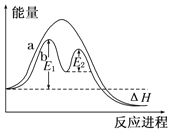 图中的E1可表示有催化剂存在的条件下,对应反应的活化能 |
分析 A.短导管进入,可排出液体,不能除杂;
B.Fe为负极,失去电子生成亚铁离子;
C.灼烧碎海带应在坩埚中进行;
D.催化剂可降低反应所需的活化能.
解答 解:A.短导管进入,可排出液体,不能除杂,则除杂时导管应长进短出,故A错误;
B.Fe为负极,失去电子生成亚铁离子,发生吸氧腐蚀,滴入KSCN溶液不变红色,不能检验亚铁离子,故B错误;
C.灼烧碎海带应在坩埚中进行,图中仪器为烧杯,不能在烧杯中灼烧,故C错误;
D.催化剂可降低反应所需的活化能,则图中的E1可表示有催化剂存在的条件下对应反应的活化能,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、电化学、活化能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
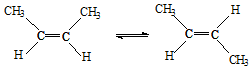 △H=-4.2kJ/mol.
△H=-4.2kJ/mol.| A. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 | |
| B. | 顺-2-丁烯比反-2-丁烯更稳定 | |
| C. | 加压和降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯的核磁共振氢谱都有两个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 图片 |  |  |  |  |
| 生活中的应用 | 食品包装袋放有小袋铁粉 | 红酒中添加规定量的 SO2 | 饼干包装盒内放有小袋硅胶 | 口服补血剂(琥珀酸亚铁)并同时服维生素 C |
| 作用 | 铁粉有抗氧化 的作用 | SO2有漂白性的作用 | 硅胶有吸水的作 用 | 维生素 C 有防止 Fe2+被 氧化的作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+的结构示意图: | |
| B. | HC1O的电子式: | |
| C. | 中子数为117、质子数为116的Lv原子:${\;}_{116}^{117}$Lv | |
| D. | HOCH2COOH 缩聚物的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3对饮用水进行杀菌、消毒 | |
| B. | 用电解氯化铝溶液的方法制取铝单质 | |
| C. | NH4F溶液储存于玻璃试剂瓶中 | |
| D. | 加热并蒸干硫酸铜溶液可得到硫酸铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | NO中氮氧键 | Cl-Cl键 | Cl-N键 | N=O键 |
| 键能/KJ/mol | 630 | 243 | a | 607 |
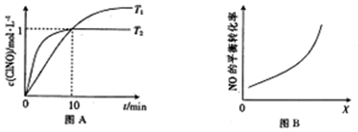
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
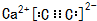 .
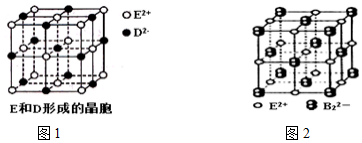
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g乙醛中所含的氧原子数为NA | |
| B. | 足量的铜与40mL10mol/L硝酸反应,生成气体的分子数为0.2NA | |
| C. | 14g乙稀中所含的C-H键数目为2NA | |
| D. | 0.1molNH3中所含的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com