
某溶液中存在大量的K+、OH﹣、CO32﹣,该溶液中还可能大量存在的离子是( )
A. Al3+ B. NH4+ C. Fe3+ D. SO42﹣
考点: 离子共存问题.
分析: A.铝离子与氢氧根离子、碳酸氢根离子反应;
B.铵根离子与氢氧根离子反应;
C.铁离子与氢氧根离子、碳酸根离子反应;
D.硫酸根离子不与钾离子、氢氧根离子、碳酸根离子反应.
解答: 解:A.OH﹣、CO32﹣都与Al3+反应,在溶液中不能大量共存,故A错误;
B.NH4+与OH﹣反应,在溶液中不能大量共存,故B错误;
C.OH﹣、CO32﹣都与Fe3+反应,在溶液中不能大量共存,故C错误;
D.K+、OH﹣、CO32﹣都不与SO42﹣反应,在溶液中能够大量共存,故D正确;
故选D.
点评: 本题考查了离子共存的判断他,题目难度中等,明确离子反应发生条件为解答关键,注意掌握离子不能共存的情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
有甲、乙、丙三种物质:
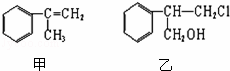
丙:
| 分子式 | C9H8O |
| 部分性质 | 能使Br2/CCl4褪色 |
(1)关于乙下列叙述正确的是
a.1mol该有机物在加热和催化剂作用下,最多能和2molNaOH反应
b.该有机物能使酸性KMnO4溶液褪色
c.该有机物的分子式为C9H11Cl
d.该有机物在一定条件下,能发生消去反应、取代反应、氧化反应和还原反应
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
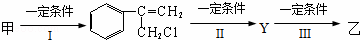
①反应Ⅰ的反应条件是
②其中反应II的化学方程式是 +
(3)由甲出发合成丙的路线之一如下:
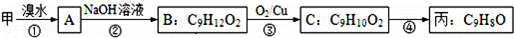
①写出反应③的化学方程式
②写出丙的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1mol•L﹣1的是()
A. 将40 g NaOH溶解于1 L 水中
B. 将22.4 LHCl溶于水配成1 L溶液
C. 将1 L 10 mol•L﹣1的浓盐酸与9 L水混合
D. 将10 g NaOH溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )
A.Na+、Ca2+、Cl-、SO42-B.Fe2+、H+、SO32-、ClO-
C.Mg2+、NH4+、Cl-、SO42-D.K+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
在溶液中能大量共存的离子组是( )
A. Na+、OH﹣、HCO3﹣ B. NH4+、NO3﹣、OH﹣
C. H+、K+、CO32﹣、 D. Ba2+、OH﹣、C1﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
在某无色透明的酸性溶液中,能共存的离子组是( )
A. Na+、K+、SO42﹣、HCO3﹣ B. Cu2+、K+、SO42﹣、NO3﹣
C. Na+、K+、Cl﹣、NO3﹣ D. Fe3+、K+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将下列离子Na+、K+、Cu2+、H+、NO3﹣、Cl﹣、CO32﹣、OH﹣,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组 ,B组 .
用同浓度的AgNO3溶液分别与同浓度等体积的NaCl、MgCl2、AlCl3溶液反应,所用AgNO3溶液的体积比为 ;如用同浓度等体积的AgNO3溶液分别与等浓度的NaCl、MgCl2、AlCl3溶液反应,所用三种溶液的体积比为 .
(3)向一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线 表示.
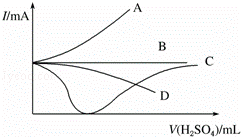
查看答案和解析>>
科目:高中化学 来源: 题型:
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是()
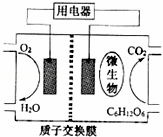
A. 该电池能够在高温下工作
B. 电池的负极反应为:C6H12O6+6H2O﹣24e﹣=6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体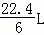
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾在不同的条件下发生的反应如下:
MnO4﹣+5e﹣+8H+═Mn2++4H2O①
MnO4﹣+3e﹣+2H2O═MnO2↓+4OH﹣②
MnO4﹣+e﹣═MnO42﹣(溶液绿色)③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的酸碱性影响.
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为 ﹣→ +.
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2,完成下列化学方程式(横线上填系数,括号内填物质):
KMnO4+ K2S+ KOH═ K2MnO4+3K2SO4+2S↓+ .
②若生成6.4g单质硫,反应过程中转移电子的物质的量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com