
下列说法正确的是( )
|
| A. | 需要加热方能发生的反应一定是吸热反应 |
|
| B. | 放热反应在常温条件下一定很容易发生 |
|
| C. | 反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 |
|
| D. | 灼热的炭与二氧化碳的反应为放热反应 |
考点:
吸热反应和放热反应.
分析:
A.需要加热方能发生的反应不一定为吸热反应;
B.氢气和氧气常温下不会反应;
C.反应物和生成物所具有的总能量的相对大小决定△H的正负;
D.灼热的碳和二氧化碳的反应为吸热反应.
解答:
解:A.需要加热方能发生的反应不一定为吸热反应,如铝热反应,故A错误;
B.放热反应在常温下不一定很容易发生,例如氢气和氧气常温下不会反应,但点燃会瞬间完成,故B错误;
C.反应物和生成物所具有的总能量的相对大小决定△H的正负,反应物的总能量大于生成物所具有的总能量为放热反应,反之为吸热反应,故C正确;
D.灼热的碳和二氧化碳的反应为吸热反应,故D错误.
故选C.
点评:
本题考查了反应过程中的能量变化,注意吸热反应、放热反应的判断及与反应条件无关,题目较简单.


科目:高中化学 来源: 题型:
下列实验操作及装置合理并能达到实验目的是( )
|
| A. |
制取并收集氨气 |
|
| B. | . 收集并测定氧气的体积 |
|
| C. | . 制乙酸乙酯 |
|
| D. | . 用苯分离出碘水中的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用________________(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用_________(填序号)。
A.H2C2O4·2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是________________;
②所配制KMnO4标准溶液的物质的量浓度为__________mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将________(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 .氯化铁水溶液呈 性,原因是(用离子方程式表示): .
(2)物质的量浓度均为0.1mol/L的下列溶液pH 由大到小的顺序 (用序号表示)
①CH3COOH ②NH4Cl ③NaHCO3 ④Ba(OH)2 ⑤NaOH ⑥Na2CO3
(3)物质的量浓度相同的下列溶液按c(CO32﹣)由大到小的顺序是
①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于燃料燃烧的说法中,不准确的是( )
|
| A. | 燃烧不一定要有氧气参加,但燃烧一定是放热反应 |
|
| B. | 化学反应中的能量变化都表现为热量变化 |
|
| C. | 为保证燃料充分燃烧,通入的空气要适当过量而不是越多越好 |
|
| D. | 为使液体燃料充分燃烧,可以将液体燃料喷成雾状,以保证燃料与空气有足够大的接触面积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4A(g)+5B(g)═4C(g)+6D(g),在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.30mol.下列叙述正确的是( )
|
| A. | A的平均反应速率是0.010 mol•L﹣1•s﹣1 |
|
| B. | 容器中含D物质的量至少为0.45 mol |
|
| C. | 容器中A、B、C、D的物质的量的比一定是4: 5:4:6 |
|
| D. | 容器中A的物质的量一定增加了0.30 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一个原子形成的离子可表示为baXn﹣,下列说法中正确的是(NA表示阿伏伽德罗常数)( )
A. baXn﹣中含有的中子数为a+b B. baXn﹣中含有的电子数为a﹣n
C. X原子的质量约为(b/NA)g D. 此元素的相对原子质量为b
查看答案和解析>>
科目:高中化学 来源: 题型:
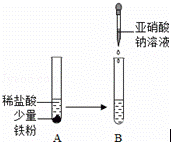
亚硝酸钠(NaNO2)俗称工业盐,外观和食盐相似,有咸味,易溶于水,水溶液显碱性,加强热时能分解产生有刺激性气味的气体,人若误食会引起中毒,致死量为0.3g~0.5g,它使人中毒是因为它能将人体血红蛋白中的Fe2+转化为Fe3+,从而使血红蛋白丧失携氧能力.
(1)以下有关亚硝酸钠的说法正确的是
a.能用紫色石蕊试液测定亚硝酸钠水溶液的酸碱性
b.亚硝酸钠在加强热时分解产生的气体是氨气
c.从使血红蛋白丧失携氧能力的角度看,亚硝酸钠使人中毒的原理与CO相同
d.利用如图进行实验,B试管中的溶液逐渐变成了黄色
(2)已知NaNO2在酸性条件下能使淀粉碘化钾试纸变蓝,同时生成一种无色气体,遇空气变红棕色.因此可选用淀粉碘化钾试纸和 (生活中常见物质)来鉴别工业盐和食盐.涉及到的反应方程式为 , .
(3)某工厂废切削液中含有2%﹣5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是
a.NaCl b.HNO3 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com