
| A. | 元素Q是短周期非金属性最强的元素 | |
| B. | Y、Z形成的化合物中只有一种属于酸性氧化物 | |
| C. | Y、Z、Q分别与W形成的化合物中,Z形成的化合物的沸点最低 | |
| D. | X分别与Y、Z、W形成的化合物中可能既含离子键又含共价键 |
分析 X、Y、Z、W、Q都是短周期主族元素,其中X是短周期原子半径最大的元素,X为Na元素,X与Y处于同一周期,Y与Z同主族且能形成两种常见的化合物,Y为S,Z为O,形成化合物为二氧化硫、三氧化硫;W能形成两种简单的离子,则W为H元素;Q原子的电子总数等于其电子层数的3倍,原子只能有2个电子层,核外电子数为6,故Q为C元素,以此来解答.
解答 解:由上述分析可知,X为Na,Y为S,Z为O,W为H,Q为C,
A.元素Q为碳元素,不是短周期非金属性最强的元素,短周期中非金属最强的元素为F元素,故A错误;
B.Y、Z形成的化合物为二氧化硫、三氧化硫,均属于酸性氧化物,故B错误;
C.Y、Z、Q分别与W形成的简单化合物为氢化物,分别为硫化氢、水、甲烷,由于水分子之间存在氢键,Z的沸点最高,故C错误;
D.Na与O元素形成的过氧化钠中既含离子键又含共价键,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该物质有三种官能团,该物质自身能发生酯化反应 | |
| B. | 1mol该物质能够消耗2mol金属钠同时放出1mol氢气 | |
| C. | 该物质能通过两种方式的反应生成两种高分子物质 | |
| D. | 该物质能使酸性高锰酸钾溶液和溴水褪色,它们的反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| B. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素中的两种或三种只能生成2种18电子的分子 | |
| B. | Z2X4可作为火箭发动机的燃料 | |
| C. | WX2中只含离子键 | |
| D. | Z的氢化物比Y的氢化物更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Pt周围的pH降低 | |
| B. | 当生成标准状况下22.4LH2时,转移的电子数为1.5 NA | |
| C. | 阳极反应式是Fe-6e-+8OH-═FeO42-+4H2O | |
| D. | 制得1mol Na2FeO4,有8molOH-从左向右通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
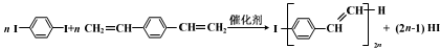
| A. | PPV 是聚苯乙烯 | |
| B. | PPV 难溶于水,易溶于乙醇等有机溶剂 | |
| C. |  属于芳香烃 属于芳香烃 | |
| D. | 1mo  最多可与5molH2发生反应 最多可与5molH2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com