
常温下,下列溶液的离子浓度关系式正确的是
A.pH=4的氯化铵溶液中:c(H+)= c(NH3·H2O )=1×10-4mol·L-1
B.pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b-1
C.pH=2的HF溶液与pH=12的NaOH溶液以体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-)
D.pH相同的①NaOH、②NaClO两种溶液中水的电离程度:①<②
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年山东省菏泽市高一下学期期末化学A卷(解析版) 题型:选择题
下列有关化学用语的表述正确的是( )
A.质子数为35、中子数为45的溴原子:
B.丙烷分子的球棍模型为: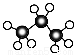
C.次氯酸的电子式为: 
D.—OH与OH- 组成元素相同,含有的电子数也相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省天门、仙桃、潜江市高一下学期期末化学试卷(解析版) 题型:填空题
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s) + H2O(g) CO(g) +H2(g) △H=+131.3 kJ·mol-1
CO(g) +H2(g) △H=+131.3 kJ·mol-1
(1)该反应的平衡常数K随温度的升高而___________(选填“增大”“ 减小”或“不变”)
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡____________(选填“向左移”“向右移”或“不移动”)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有___________(填序号)。
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+ H2O(g) CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________________。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________________。
(5)己知:① C(s)+H2O(l) CO(g)+H2(g) △H1
CO(g)+H2(g) △H1
② 2CO(g)+O2(g)=2CO2 (g) △H2
③ H2O (l)=H2 (g)+1/2 O2 (g) △H3
则C(s)+O2 (g)=CO2 (g)的△H=_____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省天门、仙桃、潜江市高一下学期期末化学试卷(解析版) 题型:选择题
现有五种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是
A. 原子半径:Y<Q<W
B. ZX3可使紫色石蕊溶液变蓝
C. X、Z、Q三种元素可组成离子化合物或共价化合物
D. X2Q2、Y2X6两种分子中含有的电子数相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省天门、仙桃、潜江市高二下学期期末化学试卷(解析版) 题型:选择题
某一化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性分别为3.44和3.98,已知AB2分子的键角为103.3o。下列推断不正确的是
A.AB2分子的空间构型为V形
B.AB2与H2O相比,AB2的熔、沸点比H2O的低
C.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
D.A—B键为极性共价键,AB2分子为非极性分子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省天门、仙桃、潜江市高二下学期期末化学试卷(解析版) 题型:选择题
因果关系完全正确的一组是
选项 | 原 因 | 结 论 |
A | 乙烯和苯都能使溴水褪色 | 苯和乙烯分子都含有碳碳双键 |
B | 乙酸乙酯和乙烯一定条件下都能和水反应 | 两者属于同一类型的反应 |
C | 乙酸和葡萄糖都能与新制的氢氧化铜悬浊液反应 | 两者所含的官能团相同 |
D | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 | 两者褪色的本质不相同 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下学期期末化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
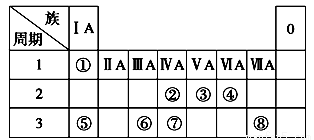
(1)画出⑧原子结构示意图__________ __;
(2)④、⑤、⑥的简单离子半径由大到小的顺序是________。(用离子符号表示)
(3)①-⑧的元素中,某元素气态氢化物与其最高价氧化物对应的水化物反应所得生成物溶于水,溶液呈酸性,原因是____ _ _(用离子方程式表示),该氢化物分子空间结构为______ _ ;
(4)写出由元素⑥组成的单质与元素⑤最高价氧化物对应的水化物的水溶液反应的离子方程式_ 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下学期期末化学试卷(解析版) 题型:选择题
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,关于该元素的说法正确的是( )
A. 在自然界中既有化合态又有游离态
B. 单质常用作半导体材料
C. 气态氢化物很稳定
D. 最高价氧化物不与任何酸反应,可制光导纤维
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下学期期末化学试卷(解析版) 题型:实验题
实验室制乙酸乙酯得主要装置如图中A所示,主要步骤:
①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。
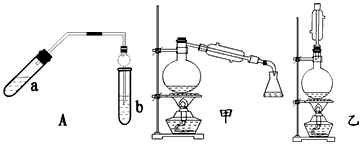
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:________
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是_____________________;步骤⑤中分离乙酸乙酯必须使用的一种仪器是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com