
 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:| A. | 原溶液一定不存在H+、Cu2+、CO32-、Fe3+ | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |
分析 根据无色溶液可知,有颜色的离子不能存在,一定不含Cu2+、Fe3+;
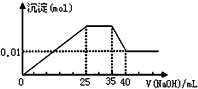
①第二份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀质量不变,则溶液中一定含NH4+;后继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+和Mg2+;由于Al3+和CO32-会发生双水解而不共存,所以溶液中一定不含CO32-,则一定含有SO42-;③第一份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为9.32g,说明溶液中CO32-和SO42-至少有一种;
根据溶液中的电荷守恒以及离子的检验方法进行解答.
解答 解:根据无色溶液可知,有颜色的离子不能存在,一定不含Cu2+、Fe3+;
①二份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,说明含有铵根离子,最后沉淀不能完全溶液,说明溶液中含Mg2+,由于Al3+和CO32-会发生双水解而不共存,所以溶液中一定不含CO32-,则一定含有SO42-,则生成的9.32g沉淀为BaSO4;
③第第一份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为9.32g,说明溶液中CO32-和SO42-至少有一种;
第二份加足量BaCl2溶液后,有白色沉淀产生,此沉淀为BaSO4,经洗涤、干燥后,沉淀质量为9.32g,则溶液中n(SO42-)=$\frac{9.32g}{233g/mol}$=0.04mol.
A、溶液中一定不含H+、Cu2+、CO32-,Fe3+,故A正确;
B、一定含NH4+、K+、Mg2+、Al3+、SO42-,可能含NO3-,故无法确定的是NO3-,故B错误;
C、氢氧化铝和NaOH溶液反应生成NaAlO2时,结合原子守恒知,c(Al3+)=$\frac{2mol/L×0.005L}{0.1L}$=0.1mol/L,c(NH4+)=$\frac{2mol/L×0.01L}{0.1L}$=0.2mol/L,溶液中c(SO42-)=$\frac{0.04mol}{0.1L}$=0.4mol/L,
根据溶液中电荷守恒知,3c(Al3+)+c(NH4+)+2(Mg2+)<2c(SO42-),所以溶液中还存在K+,还可能含有NO3-,且根据电荷守恒可知,溶液中的c(K+)≥0.1mol/L,所以
| 一定含有的离子种类 | Mg2+ | NH4+ | Al3+ | K+ |
| 物质的量浓度(mol/L) | 0.1 | 0.2 | 0.1 | ≥0.1 |
点评 本题考查了离子共存、离子反应的计算等知识点,定性分析离子共存、定量分析离子的物质的量是解本题的关键,题目难度大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝 | |
| D. | DNOP(邻苯二甲酸二辛酯)是一种由邻苯二甲酸和正辛醇经酯化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
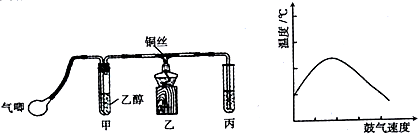
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子结构决定了元素在周期表中的位置 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在过渡元素中寻找半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
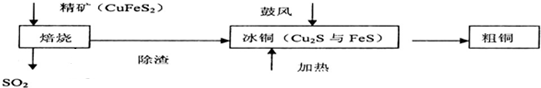
| A. | 焙烧时硫元素全部转化为二氧化硫 | B. | 在焙烧时氧化剂只有氧气 | ||
| C. | 粗铜精炼时用粗铜做阴极 | D. | Cu2S可用于火法炼制铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com