
| A. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 | |
| B. | 卤族元素从C1到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX水溶液酸性增强 | |
| D. | 卤素单质从F2到I2颜色加深,熔沸点升高 |
分析 A.元素的非金属性越强,其单质的氧化性越强,氟气和水发生剧烈反应生成HF和氧气;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其吸引电子能力越强,其氢化物在水溶液中电离出氢离子能力越弱;
D.卤素单质随着原子序数增大其颜色加深、熔沸点升高.
解答 解:A.元素的非金属性越强,其单质的氧化性越强,氟气和水发生剧烈反应生成HF和氧气,卤素单质中除了氟气外,排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,从氟到碘其非金属性逐渐减弱,则其最高价氧化物的水化物酸性依次减弱,故B正确;
C.元素的非金属性越强,其吸引电子能力越强,其氢化物在水溶液中电离出氢离子能力越弱,从氟到碘其非金属性依次减弱,其氢化物的水溶液酸性依次增强,故C正确;
D.卤素单质从氟气到碘,其单质颜色依次为浅黄绿色、黄绿色、深红棕色、紫黑色,这几种物质的单质都是分子晶体,其单质的熔沸点随着原子序数增大而增大,所以从氟到碘其熔沸点依次升高,故D正确.
故选A.
点评 本题考查卤族元素性质递变规律,注意A中氟气能置换出水中的氧气、C中非金属性与其氢化物溶液酸性强弱关系,AC为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 资料1 | 硫酸浓度mol/L | 黑色物质出现的温度∕℃ | 黑色物质消失的温度∕℃ |
| 15 | 约150 | 约236 | |
| 16 | 约140 | 约250 | |
| 18 | 约120 | 不消失 | |
| 资料2 | X射线衍射晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. | ||
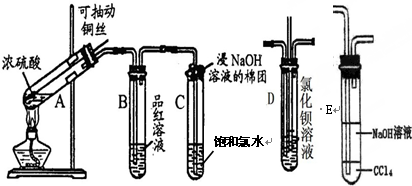
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
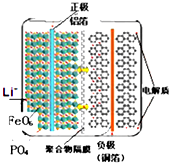
| A. | 放电时,铝箔所在电极为负极,铜箔所在电极为正极 | |
| B. | 放电时,电池反应式为:FePO4+Li═LiFePO4 | |
| C. | 充电时,Li+向阴极移动 | |
| D. | 充电时,阳极的电极反应式为:LiFePO4-e-═FePO4+Li+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
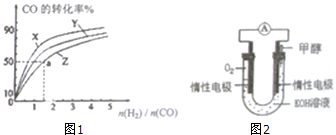 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是 H2 (g)+Cl2 (g)═2HCl(g) | |
| B. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═+183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) | |
| D. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com