
【题目】在无色透明溶液中可以大量共存的离子组是( )
A.H+、Na+ 、S2﹣、CO32﹣
B.H+、Ca2+ 、MnO ![]() ?、NO
?、NO ![]()
C.K+ 、Ca2+ Cl﹣、 HCO ![]()
D.Cl﹣、 Mg2+ 、Al3+ 、OH﹣
【答案】C
【解析】解:无色溶液时可排除 Cu2+、Fe2+、Fe3+、MnO4﹣等有色离子的存在, A.H+与S2﹣、CO32﹣发生反应,在溶液中不能大量共存,故A错误;
B.MnO4﹣为有色离子,在溶液中不能大量存在,故B错误;
C.K+、Ca2+、Cl﹣、HCO3﹣之间不发生反应,都是无色离子,在溶液中能够大量共存,故C正确;
D.Mg2+、Al3+都与OH﹣发生反应,在溶液中不能大量共存,故D错误;
故选C.
无色时可排除 Cu2+、Fe2+、Fe3+、MnO4﹣等有色离子的存在,
A.氢离子与硫离子、碳酸根离子反应;
B.高锰酸根离子为有色离子;
C.四种离子之间不反应,都是无色离子;
D.镁离子、铝离子与氢氧根离子反应.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】某学生实验兴趣小组拟用图1装置气体排液法来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验.
已知:Na2CO3+CO2+H2O=2NaHCO3 , CO2难溶于饱和NaHCO3溶液.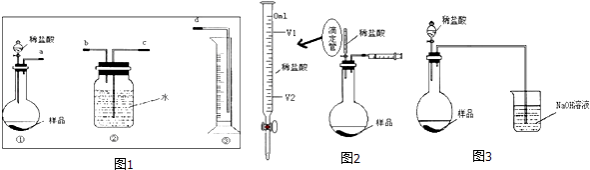
(1)各仪器接口连接顺序是(用接口字母填写).
(2)甲同学认为上述方法误差较大,提出如下改进措施,你认为可行的有 . (填序号)
A.在装置②中水面上滴加少量植物油
B.在装置①中稀盐酸换成稀硫酸,装置②中水换成饱和NaHCO3溶液
C.在装置②中水换成饱和Na2CO3溶液
D.滴加盐酸不宜过快
(3)乙同学认为在装置②③之间的导管内会积存水,使测定结果不准,从而改用图2装置.假定滴定管(用于准确测定滴加液体体积的仪器,其中0刻度在最上面,刻度从上到下依次增大)起始读数为V1mL,终了读数为V2mL,而注射器测定排出的气体为V3mL(标准状况下),混合物样品质量为m g,则原混合物中NaHCO3的质量分数的表达式为(用含V1、V2、V3、m的式子表示).
(4)丙同学改用图3装置,通过测定烧杯中NaOH溶液的增重来确定样品中NaHCO3的含量.你认为乙、丙两同学的方案中,谁的方案更合理 , 理由是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合亚铜(由[Cu(NH3)2]+和CH3COO-构成)溶液来吸收原料气中的CO气体,其反应的离子方程式为:[Cu(NH3)2]++CO+NH3![]() [Cu (NH3)3CO]+
[Cu (NH3)3CO]+
(1)Cu+基态核外电子排布式________________.
(2)醋酸二氨合亚铜所含元素原子中第一电离能最大的是____________。
(3)写出一种与NH3分子互为等电子体的阳离子_______________。
(4)CH3COO-中碳元素的杂化类型为______________。
(5)1mol [Cu(NH3)3CO]+含有σ键的数目为______________。
(6)N4H4(SO4)2遇碱可生成一种形似白磷的N4分子。画出N4H44+的结构式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )

A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
D. 装置③可用于收集H2、CO2、Cl2、NH3等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(s)ΔH >0,若0~15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( )
H2(g)+I2(s)ΔH >0,若0~15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率也加快
D. 减小反应体系的体积,正逆反应速率增大程度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)H2SO4的摩尔质量为;0.3mol的NH4+中含有个电子;
(2)①标准状况下22.4L CH4 ②1.5mol NH3 ③1.806×1024个H2O ④标准状况下73g HCl所含H原子个数由多到少的顺序为(填序号);
(3)在含0.4mol Al2(SO4)3的溶液中SO42﹣的物质的量为;
(4)某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是;
(5)取100mL a mol/L HCl溶液与300mL n mol/L H2SO4溶液均注入到500mL的容量瓶中,加水稀释到刻度线,则该混合溶液中H+的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。

(1)仪器A的名称是________________。安装F中导管时,应选用图2中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜__________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_____________,

理由:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能,如图是用固体氧化物作“直接煤燃料电池”的电解质。下列有关说法正确的是( )

A. 电极b为电池的负极 B. 电子由电极a沿导线流向b
C. 电池反应为C+CO2===2CO D. 煤燃料电池比煤直接燃烧发电能量利用率低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g)![]() COCl2(g)
COCl2(g)
其中容器Ⅰ中5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ中加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO的转化率大于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com