
| A. | 1.8 g重水(D2O)中含有的质子数和中子数均为NA | |
| B. | 将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA | |
| C. | 100 mL 12 mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
分析 A、重水的摩尔质量为20g/mol;
B、氯气所处的状态不明确;
C、铜与浓硝酸反应,开始硝酸被还原为+4价,后来硝酸变稀,被还原为+2价;
D、甲烷和乙烯中均含4氢原子.
解答 解:A、重水的摩尔质量为20g/mol,故1.8g重水的物质的量为n=$\frac{1.8g}{20g/mol}$=0.09mol,而1mol重水中含10mol质子和10mol中子,故0.09mol重水中含0.9mol质子和0.9mol中子即均为0.9NA个,故A错误;
B、氯气所处的状态不明确,故气体摩尔体积的数值不明确,则其物质的量不一定是0.5mol,故转移的电子数不一定是0.5NA个,故B错误;
C、铜与浓硝酸反应,开始硝酸被还原为+4价,后来硝酸变稀,被还原为+2价,但由于被还原为+4价和+2价的硝酸的物质的量不明确,故转移的电子的物质的量无法计算,故C错误;
D、标况下11.2L混合气体的物质的量为0.5mol,而甲烷和乙烯中均含4氢原子,故0.5mol混合气体中含2mol氢原子即2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
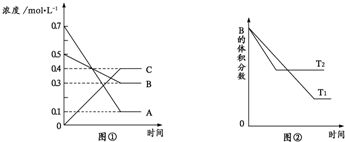
| A. | 该反应的化学方程式是A+3B═2C | |
| B. | 该反应的正反应为放热反应 | |
| C. | 定容条件下,混合气体的密度不再变化,则证明该反应达到平衡 | |
| D. | 压强增大,则该反应的正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中:C (Cl2)=2[C (ClO-)+C (Cl-)+C (HClO)] | |
| B. | 氯水中:c(C l-)>C (H+)>C (OH-)>C (ClO-) | |
| C. | 等体积等浓度的氢氧化钠与醋酸混合:C (Na+)=C (CH3COO-) | |
| D. | Na2CO3溶液中:C (Na+)>C (CO${\;}_{3}^{2-}$)>C (OH-)>C (HCO${\;}_{3}^{-}$)>C (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的质量分数为7.8% | B. | 溶液中溶质的质量大于7.8g | ||
| C. | 溶液中水的质量等于92.2g | D. | 溶液的质量等于100g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com