
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 原子半径大小:Na>Mg>Al | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
分析 A、元素的非金属性越强,最高价氧化物对应的水化物的酸性越强;
B、同周期从左到右,元素原子半径逐渐减小;
C、元素的金属性越强,最高价氧化物对应的水化物的碱性越强;
D、同周期元素从左到右金属性逐渐减弱,同主族元素从上到下金属性逐渐增强.
解答 解:A、非金属性:Cl>Br>I,最高价氧化物对应的水化物的酸性:HClO4>HBrO4>HIO4,故A错误;
B、同周期从左到右,元素原子半径逐渐减小,所以原子半径:Na>Mg>Al,故B正确;
C、金属性:K>Na>Li,最高价氧化物对应的水化物的碱性:KOH>NaOH>LiOH,故C正确;
D、同周期元素从左到右金属性逐渐减弱,所以金属性Na>Mg>Al,故D正确;
故选:A.
点评 本题考查同周期、同主族元素的性质,熟悉元素周期律及元素性质的比较方法即可解答,难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应的正反应为放热反应 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 反应的热化学方程式可表示为:CO(g)+H2O(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO2(g)+H2(g)△H<0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Cl-、K+、HS- | |
| B. | 水电离出的c(H+)=10-12mol/L中:Ba2+、K+、Cl-、CO32- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的水溶液中:CH3COO-、CO32-、Na+、K+ | |
| D. | c(Al3+)=1mol/L的溶液中:Na+、NO3-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | PCl3 | C. | SiCl4 | D. | XeF4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
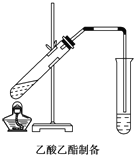 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率关系是:3υ(NH3)═2υ(H2O) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 | |
| D. | 达到化学平衡时,5υ正(O2)=4υ逆(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com