
| A. | 碳碳键键长:乙烯>苯 | B. | 沸点:正戊烷>异戊烷 | ||
| C. | 相对密度: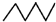 > >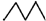 | D. | 水溶性:CH3CH2OH>CH3CH2Br |
分析 A.苯环中碳碳键是介于碳碳单键和碳碳双键之间的特殊键,其键长介于碳碳单键和碳碳双键之间;
B.同分异构体中支链越多其熔沸点越低;
C.烷烃中碳原子个数越多其相对密度越大;
D.水溶性:醇>卤代烃.
解答 解:A.苯环中碳碳键是介于碳碳单键和碳碳双键之间的特殊键,其键长介于碳碳单键和碳碳双键之间,所以碳碳键键长:乙烯<苯,故A错误;
B.同分异构体中支链越多其熔沸点越低,正戊烷不含支链、异戊烷含有一个甲基,所以熔沸点正戊烷>异戊烷,故B正确;
C.烷烃中碳原子个数越多其相对密度越大,前者是己烷、后者是戊烷,所以相对密度前者大于后者,故C正确;
D.水溶性:醇>卤代烃,乙醇中含有亲水基-OH,溴乙烷中不含亲水基,所以水溶性:CH3CH2OH>CH3CH2Br,故D正确;
故选A.
点评 本题考查有机化学基础,涉及键长大小比较、有机物熔沸点及相对密度比较、有机物水溶性比较等知识点,明确有机化学基本理论知识是解本题关键,注意苯中不含碳碳双键和碳碳单键,为易错点.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
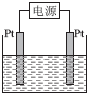 熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3为电解质,以丁烷(C4H10)为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为2C4H10+26CO${\;}_{3}^{2-}$-52e-═34CO2+10H2O.
熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3为电解质,以丁烷(C4H10)为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为2C4H10+26CO${\;}_{3}^{2-}$-52e-═34CO2+10H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H 2O>溴苯>苯 | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O 2量:乙炔>乙烯>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 +2H2O.
+2H2O.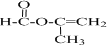 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖(C6H12O6)与蔗糖(C12H22O11) | B. | 醋酸与甲酸甲酯(C2H4O2) | ||
| C. | 乙醇与甲醛(CH2O) | D. | 二甲醚(C2H6O)与乳酸(C3H6O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com