
| A. | BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 | |
| B. | BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 | |
| C. | 向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=4.4×10-2 | |
| D. | 常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于 2.2×10-6 mol•L-1 |
分析 A.难溶电解质的溶解平衡中,溶度积大的能向溶度积小的转化;
B.BaCO3能溶于胃酸;
C.根据Ksp(BaSO4 和Ksp(BaCO3)计算可求出;
D.Qc=c(SO42-)•c(Ba2+)≥Ksp(BaSO4 ),开始转化为BaSO4.
解答 解:A.难溶电解质的溶解平衡中,溶度积大的能向溶度积小的转化所以,BaCO3可以转化为BaSO4;故A正确;
B.因胃酸可与CO32-反应生成水和二氧化碳,使CO32-浓度降低,从而使平衡BaCO3(s)?Ba2+(aq)+CO32-(aq) 向溶解方向移动,使Ba2+浓度增大,Ba2+有毒,所以BaCO3不可以做钡餐试剂,故B错误;
C.根据Ksp(BaSO4 )和Ksp(BaCO3)计算可求出$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=4.4×10-2;故C正确;
D.Ksp(BaCO3)=c(CO32-)•c(Ba2+)=2.5×10-9,所以c(Ba2+)=5×10-5 Qc=c(SO42-)•c(Ba2+)≥Ksp(BaSO4 )开始转化为BaSO4,所以c(SO42-)=$\frac{Ksp(BaS{O}_{4})}{c(B{a}^{2+})}$=$\frac{1.1×10-10}{5×10-5}$=2.2×10-6 mol•L-1;故D正确;
故选B.
点评 本题考查了沉淀之间的转化,沉淀溶解平衡的移动,Ksp的有关计算,综合性较强,题目难度中等,注意把握沉淀溶解平衡的原理及影响因素是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| B. | 常用新制的氢氧化铜检验司机酒后驾车 | |
| C. | 棉花和木材的主要成分都是纤维素 | |
| D. | 蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑.请回答:铁锅的锈蚀是吸氧腐蚀(填“析氢”或“吸氧”).写出铁锅腐蚀正极的电极反应式:2H2O+O2+4e-=4OH-
(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑.请回答:铁锅的锈蚀是吸氧腐蚀(填“析氢”或“吸氧”).写出铁锅腐蚀正极的电极反应式:2H2O+O2+4e-=4OH-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用比室温约高10~20℃的水溶解明矾晶体得到饱和溶液 | |
| B. | 使明矾饱和溶液急速冷却 | |
| C. | 选用形状较为规则的小明矾晶体作晶核 | |
| D. | 结晶过程中,应将硬纸板盖住盛有饱和溶液的烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 L | B. | 11.2 L | C. | 22.4 L | D. | 33.6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨是极性分子,其在水中的溶解度很大 | |
| B. | DNA中的碱基互补配对是通过氢键来实现的 | |
| C. | 气体单质中,一定有σ键,可能有π键 | |
| D. | 元素“氦、铷、铯”等是用光谱分析方法发现的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
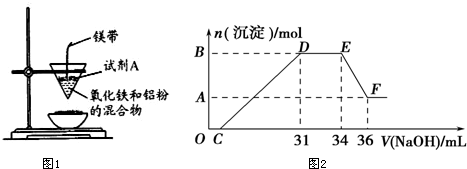
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com