
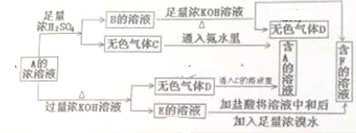


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A) |
| B、c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) |
| C、c(H+)+c(A2-)=c(OH-)+c(H2A) |
| D、c(Na+)=c(HA-)+c(H2A)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
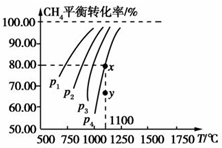 在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H>0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃,P1时该反应平衡常数约为16.4 |
| D、压强为p4时,在y点:V正>V逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的百分含量不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率υA:υB:υC:υD=m:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
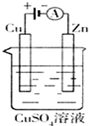 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
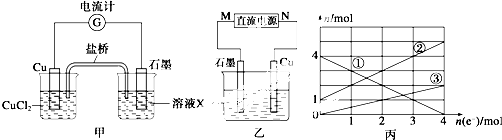
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
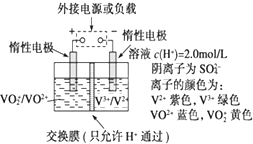 全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com