


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
| A、放电时正极发生的反应是:Pb(s)+SO42-(aq)-2e-═PbSO4(s) |
| B、放电时该电池的负极材料是铅板 |
| C、充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
| D、充电时,电池中硫酸的浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5×(10-14+10-12) mol?L-1 |
| B、5×(10-15+10-11) mol?L-1 |
| C、2.0×10-1 mol?L-1 |
| D、2.0×10-14 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B、中和反应都是放热反应,一定条件下二氧化碳被碳还原是吸热反应 |
| C、在101 kPa时,1 mol碳燃烧所放出的热量一定叫碳的燃烧热 |
| D、CO燃烧是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
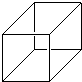 “立方烷”是一种新合成的烃,其分子为正立方体结构,其碳骨架结构如图所示:
“立方烷”是一种新合成的烃,其分子为正立方体结构,其碳骨架结构如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com