
0.1 mol·L-1某碱AOH溶液的pH=11,将该溶液稀释10倍后,溶液的pH不可能为( )
①10.1 ②10.8 ③12 ④11.5
A.③④ B.①②
C.①③ D.②④
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
2008年的秋天,毒奶粉事件震动全国,这主要是奶粉中含有有毒的三聚氰胺(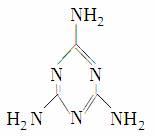 )。下列关于三聚氰胺分子的说法中正确的是( )
)。下列关于三聚氰胺分子的说法中正确的是( )
A.所有氮原子均采取sp3杂化
B.一个三聚氰胺分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.三聚氰胺分子中只含有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq)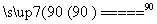 NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)

(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是________________________________________________________________________
________________________________________________________________________。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线见上图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)____________________、干燥。
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如下图所示(加热和仪器固定装置已略去),实验步骤如下:
步骤1:按下图所示组装仪器,检查装置气密性。
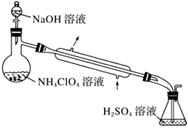
步骤2:准确称取样品a g(约0.5 g)于蒸馏烧瓶中,加入约150 mL水溶解。
步骤3:准确量取40.00 mL约0.1 mol·L-1H2SO4溶液于锥形瓶中。
步骤4:经分液漏斗向蒸馏烧瓶中加入20 mL 3 mol·L-1NaOH溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤8:将实验步骤1~7重复2次。
①步骤3中,准确量取40.00 mL H2SO4溶液的玻璃仪器是__________________________。
②步骤1~7中,确保生成的氨被稀硫酸完全吸收的实验步骤是_________________
(填步骤序号)。
③为获得样品中NH4ClO4的含量,还需补充的实验是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X,为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
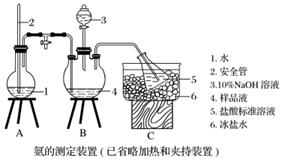
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_____________________________________________
________________________________________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用______式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是_____________________________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO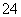 )为________ mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________ mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________。制备X的化学方程式为______________________________________________________
________________________________________________________________________;
X的制备过程中温度不能过高的原因是____________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560 ℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
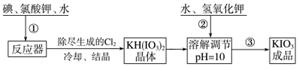
(1)步骤②中氢氧化钾的主要作用是_____________________________________。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过________、过滤、洗涤、干燥等步骤。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100 g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(3)已知:KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O;I2+2S2O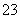 ===2I-+S4O
===2I-+S4O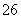
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取w g食盐、加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3 mol·L-1的Na2S2O3溶液滴定,消耗10.00 mL时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为________、______。
②该实验可以用________作指示剂,滴定终点的现象是________________________。
③下列有关该滴定实验的说法不正确的是________(填序号)。
A.滴定管在使用前必须检查是否漏水并润洗
B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁
D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是________(以含w的代数式表示)g·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:
Al3++4NH3·H2O===AlO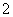 +4NH
+4NH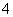 +2H2O
+2H2O
B.浓烧碱溶液中加入铝片:
Al+2OH-===AlO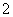 +H2↑
+H2↑
C.用浓NaOH溶液溶解Al2O3:
2OH-+Al2O3===2AlO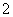 +H2O
+H2O
D.往碳酸镁中滴加稀盐酸:
CO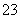 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
鉴别苯酚溶液、己烷、己烯、乙酸溶液和乙醇液体,可选用的最佳试剂是
( )。
A.溴水、新制的Cu(OH)2
B.FeCl3溶液、金属钠、溴水、石蕊试液
C.石蕊试液、溴水
D.KMnO4酸性溶液、石蕊试液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关焰色反应实验操作注意事项的说法中正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
⑤没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全对
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com