
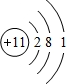 ,
,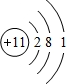 ;
;

 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:不详 题型:填空题
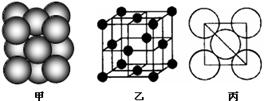
| | | | |||||||||||||||
| | | | | | A | | | | |||||||||
| | | B | | | C | | | ||||||||||
| | | | | | | D | E | | | | | | | | | | |
| 元 素 | D | E | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
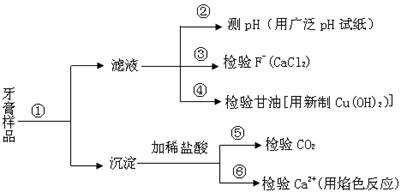
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.②③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.因为酸性:HCl>H2CO3,所以非金属性:Cl>C |
| B.元素原子的最外层电子数越多,越容易得电子 |
| C.同周期主族元素的原子形成的简单离子电子层结构相同 |
| D.同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.短周期元素形成离子后,最外层均达8电子稳定结构 |
| B.多电子原子中,在离核较近的区域运动的电子能量较低 |
| C.非金属元素组成的化合物中只有共价键 |
| D.HF、HCl、HBr、HI的热稳定性和还原性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com