
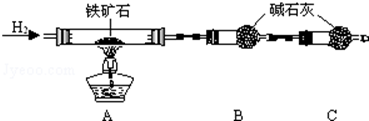
分析 Ⅰ.(1)组装仪器完毕,需要检验装置的气密性;
(2)B中的碱石灰是吸收置换反应生成的水的,为了防止空气成分对实验的影响,要加一个装置吸收空气中的水以及二氧化碳;
(3)反应后装置B增重1.35g,即氢气和氧化铁反应后固体质量的增加值,可以根据差量法来计算;
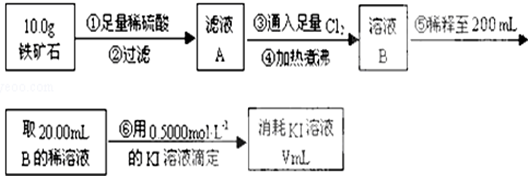
Ⅱ.(1)煮沸可以将水中的气体赶走;
(2)根据滴定试验以及滴定过程中的实验误差分析知识来回答判断;
(3)根据元素守恒和化学反应方程式进行计算.
解答 解:Ⅰ.(1)组装仪器完毕,需要检验装置的气密性,
故答案为:检验装置的气密性;
(2)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,B处的干燥管作用是吸收产生的水蒸气,所以C装置要防止防止空气中的水蒸气和CO2进入B中,影响测定结果,
故答案为:防止空气中的水蒸气和CO2进入B中,影响测定结果;
(3)测的反应后装置B增重1.35g,根据反应的实质,增加的是水的质量,根据质量守恒定律,所以铁矿石中氧的百分含量是:$\frac{\frac{1.35}{18}×16}{5.0}$×100%=24%,
故答案为:24%;
Ⅱ.(1)向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸后可以降低氯气的溶解度,赶走溶液中溶解的过量的Cl2,
故答案为:赶走溶液中溶解的过量的Cl2;
(2)a.滴定管用蒸馏水洗涤后必须用标准液润洗,故a错误;
b.锥形瓶不需要用待测液润洗,故b正确;
c.滴定过程中,眼睛注视锥形瓶中颜色的变化,故c错误;
d.滴定结束后,30s内溶液不恢复原来的颜色再读数,故d正确.
故答案为:bd;
(3)根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI),即:0.4000mol•L-1×0.025L=c(Fe3+)×0.02L,解得c(Fe3+)=0.5mol•L-1,所以铁元素的百分含量为:$\frac{0.5mol/L×0.25L×56g/mol}{10g}$×100%=70%,
故答案为:70%.
点评 本题考查了探究铁矿石中氧元素和铁元素的含量的方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力;该类试题综合性强,理论和实践的联系紧密,要求学生必须认真、细致的审题,联系所学过的知识和技能,全面细致的思考才能得出正确的结论,难度中等.


科目:高中化学 来源: 题型:解答题
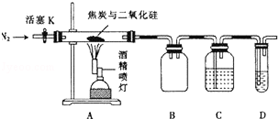 某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究.
某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
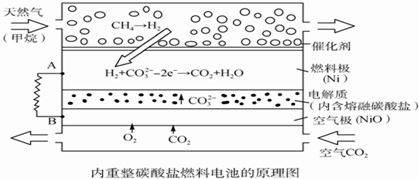
| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可使湿的红布条褪色,所以氯气具有漂白性 | |
| B. | 氯气没有漂白性,但通入品红溶液中,品红褪色 | |
| C. | 氯气不跟非金属反应 | |
| D. | 氯气有毒,闻其气味时要小心将集气瓶放在鼻孔下直接闻其气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阴极的电极反应式为 2Cl--2e-═Cl2↑ | |
| B. | 放电时,铅蓄电池中硫酸浓度不断减小 | |
| C. | 氢氧燃料电池中,当电路上有1mol 电子通过时,则正极上消耗氧气为5.6L | |
| D. | 以锌片、铜片、稀硫酸组成原电池,当溶液中通过0.2mol电子时,负极减轻6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com