

 CuSO4 + SO2↑ + H2O(2)观察气体通量、干燥(3)①防止造成污染 ②Na2SO3、Na2SO4 ③ 4OH- + 2SO2 + O2 = 2SO42- + 2H2O ④ c、d
CuSO4 + SO2↑ + H2O(2)观察气体通量、干燥(3)①防止造成污染 ②Na2SO3、Na2SO4 ③ 4OH- + 2SO2 + O2 = 2SO42- + 2H2O ④ c、d CuSO4 + SO2↑ + H2O(2)浓硫酸可以除去气体中掺杂的水蒸气,并且观察气体生成状况,B装置的作用观察气体通量、干燥(3)①抑制反应进行,防止造成污染;②溶解得无色溶液W中加入酸性KMnO4溶液,紫色褪去,说明有还原剂,加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀,说明有硫酸根,即C为Na2SO3、Na2SO4 ③D装置是为了除去产生的二氧化硫防止污染,其反应离子方程式4OH- + 2SO2 + O2 = 2SO42- + 2H2O ④反应得到的黑色物质溶于硝酸且产生红棕色气体,即发生氧化还原反应生成NO2,向溶于中加入BaCl2溶液,产生白色沉淀,则有硫酸根离子,故黑色物质可能是c、d。
CuSO4 + SO2↑ + H2O(2)浓硫酸可以除去气体中掺杂的水蒸气,并且观察气体生成状况,B装置的作用观察气体通量、干燥(3)①抑制反应进行,防止造成污染;②溶解得无色溶液W中加入酸性KMnO4溶液,紫色褪去,说明有还原剂,加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀,说明有硫酸根,即C为Na2SO3、Na2SO4 ③D装置是为了除去产生的二氧化硫防止污染,其反应离子方程式4OH- + 2SO2 + O2 = 2SO42- + 2H2O ④反应得到的黑色物质溶于硝酸且产生红棕色气体,即发生氧化还原反应生成NO2,向溶于中加入BaCl2溶液,产生白色沉淀,则有硫酸根离子,故黑色物质可能是c、d。

科目:高中化学 来源:不详 题型:单选题
| A.浓硝酸和浓硫酸露置于空气中,容器内酸液的浓度都降低 |
| B.可用铁制容器储存稀硝酸 |
| C.SO2溶于水生成H2SO4 |
| D.SO2通入BaCl2溶液中能产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
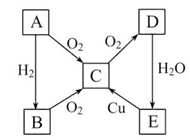
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| 选项 | 实验现象 | 解释或结论 |
| A | a中溴水褪色 | 还原性:SO32—> Br— |
| B | b中加硫酸后产生淡黄色沉淀 | SO32—和S2—在酸性条件下发生反应 |
| C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32—+H2O HSO3—+OH—,所以滴入酚酞变红; HSO3—+OH—,所以滴入酚酞变红;Ba2++SO32—→BaSO3↓(白),使水解平衡左移,红色褪去 |
| D | d中产生白色沉淀 | Na2SO3溶液已被氧化变质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①⑤ | B.③④⑤ | C.②⑥ | D.②③④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有机物不导电 | B.金刚石是自然界最硬的物质 |
| C.SO2可用作食品防腐剂 | D.NO可用于某些疾病的治疗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
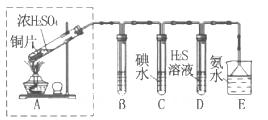
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
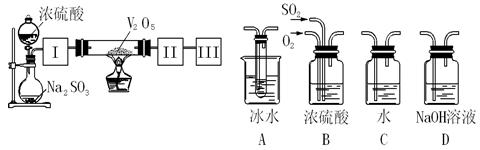
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O| A.一定没有亚硫酸钡沉淀 |
| B.一定有硫酸钡沉淀生成 |
| C.得到的沉淀是亚硫酸钡和硫酸钡的混合物 |
| D.逸出的气体是氨气和二氧化硫气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com