
| A.CO2 | B.CCl4 | C.CH2Cl2 | D.H2O |
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据相似相溶原理,利用CCl4萃取溴水中的Br2 |
| B.Na2CO3与CaCO3都是电解质,但Na2CO3在相同温度下溶解度更大 |
| C.卤化氢都易溶于水,且都得到强酸性溶液 |
| D.乙酸与甲酸甲酯(HCOOCH3)互为同分异构体,乙酸比甲酸甲酯易溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
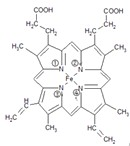
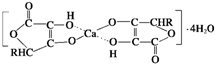
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
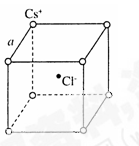
A.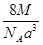 g· cm-3 g· cm-3 | B.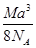 g· cm-3 g· cm-3 |
C.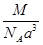 g· cm-3 g· cm-3 | D.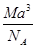 g· cm-3 g· cm-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
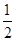 ,n=3、l=1、m=0、ms=+
,n=3、l=1、m=0、ms=+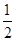 。则A、B两元素所形成化合物的晶体类型为( )。
。则A、B两元素所形成化合物的晶体类型为( )。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com