
| A. | 前者是混合物,后者是纯净物 | |
| B. | 两者都具有丁达尔效应 | |
| C. | 分散质的粒子直径均在1~100nm之间 | |
| D. | 前者可用于杀菌,后者可用于净水 |
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的 ①NH4Cl溶液②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2CO3溶液中NH4+浓度的大小关系是 ②>④>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| A. | △H=△H1-△H2 | |
| B. | K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 该反应进行时不断分离出H2O,可以提高CO2的转化率和反应速率 | |
| D. | 该反应正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
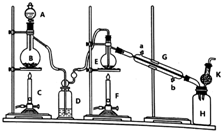 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能使湿润的有色布条褪色,所以Cl2具有漂白性 | |
| B. | 红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl3 | |
| C. | 利用溴单质的氧化性可以把碘离子转化为碘单质 | |
| D. | 实验室常用NaOH溶液吸收多余的Cl2以避免污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油的裂解可以提高汽油等轻质油的质量和产量 | |
| B. | 在一定条件下煤和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 葡萄糖、淀粉、油脂在一定条件下都能发生水解反应 | |
| D. | 往蛋白质溶液中加入饱和硫酸铵溶液,产生的沉淀再加水又可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
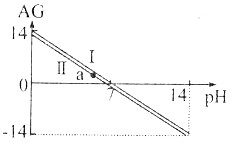
| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com