
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.分析 (1)AX3与气体X2反应生成lmol AX5,放出热量123.8kJ,根据反应物和生成物状态及反应热写出相应的热化学方程式;
(2)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
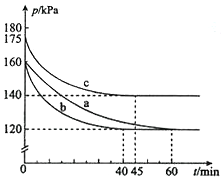
②由图可知,实验a在60min时到达平衡,平衡时AX3的α=2(1-$\frac{P}{{P}_{0}}$)=2×(1-$\frac{120}{160}$)=50%,则参加反应AX3的物质的量为0.2mol×50%=0.1mol,根据方程式可知生成AX5的物质的量,再根据v=$\frac{△c}{△t}$计算v(AX5);
③由于恒温恒容下,压强之比等于气体物质的量之比,故相同时间内压强变化量越大,反应速率越快;
实验a、b相比,起始压强相等,平衡时压强不变,改变条件不影响平衡移动,但b到达平衡的时间较短,反应速率较快,由于反应前后气体的体积减小,b应是使用催化剂;
a、c相比c组的反应速率加快,平衡时c的压强变化相对较小,说明与a相比,平衡逆向移动,说明是温度升高;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,而c组的温度高于a组;
c组平衡时,AX3的平衡转化率αc为40%,平衡常数K=$\frac{c(A{X}_{5})}{c(A{X}_{3}).c({X}_{2})}$=$\frac{n(A{X}_{5})}{n(A{X}_{3}).n({X}_{2})}$×V=($\frac{0.2α}{0.2(1-α)×0.2(1-α)}$×10)L/mol,代入数据计算.
解答 解:(1)因为AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃,则室温时,AX3为液态,AX5为固态,生成1mol AX5,放出热量123.8kJ,该反应的热化学方程为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1,
故答案为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1;
(2)①A.混合气体总质量不变,随反应进行总物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量保持不变,说明反应到达平衡,故A正确;
B.混合气体总质量不变,容器体积不变,混合气体密度始终保持不变,不能说明到达平衡,故B错误;
C.X2的体积分数保持不变,说明到达平衡,故C正确;
D.每消耗1mol AX3的同时消耗1mol AX5,则消耗1mol AX5的同时生成1molAX3,AX3的生成速率与消耗速率相等,反应到达平衡,故D正确,
故选:B;
②由图可知,实验a在60min时到达平衡,平衡时AX3的α=2(1-$\frac{P}{{P}_{0}}$)=2×(1-$\frac{120}{160}$)=50%,则参加反应AX3的物质的量为0.2mol×50%=0.1mol,由方程式可知生成AX5的物质的量为0.1mol,故v(AX5)=$\frac{\frac{0.1mol}{10L}}{60min}$=0.00017mol/(L•min ),
故答案为:0.00017mol/(L•min );
③由于恒温恒容下,压强之比等于气体物质的量之比,故相同时间内压强变化量越大,反应速率越快,由图可知,从开始到平衡时a、b、c压强分别为40kPa、40kPa、35kPa,所用时间分别为60min、40min、45min,每分钟内压强平均变化分别为$\frac{40}{60}$Pa、$\frac{40}{40}$Pa、$\frac{35}{45}$Pa,故反应速率b>c>a;
实验a、b相比,起始压强相等,平衡时压强不变,改变条件不影响平衡移动,但b到达平衡的时间较短,反应速率较快,由于反应气体气体的体积减小,b应是使用催化剂;
a、c相比c组的反应速率加快,平衡时c的压强变化相对较小,说明与a相比,平衡逆向移动,说明是温度升高;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,而c组的温度高于a组,故平衡常数Ka>Kc;
c组平衡时,AX3的平衡转化率αc为40%,平衡常数K=$\frac{c(A{X}_{5})}{c(A{X}_{3}).c({X}_{2})}$=$\frac{n(A{X}_{5})}{n(A{X}_{3}).n({X}_{2})}$×V=($\frac{0.2α}{0.2(1-α)×0.2(1-α)}$×10)L/mol=($\frac{0.2×0.4}{0.2(1-0.4)×0.2(1-0.4)}$×10)L/mol=55.6L/mol,
故答案为:b>c>a;加入催化剂;升高温度;>;55.6L/mol.
点评 本题考查化学平衡计算,过程复杂且为字母型计算,属于易错题目,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度较大,注意(1)(2)方程式中部分物质状态不同.


科目:高中化学 来源: 题型:选择题
| A. | Al65Cu23Fe12的硬度比金属Al、Cu、Fe的硬度大 | |
| B. | Al65Cu23Fe12中三种金属的化合价均可视作零 | |
| C. | Al65Cu23Fe12不可用作长期浸泡在海水中的材料 | |
| D. | 1mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题:
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题: ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

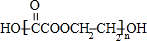 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
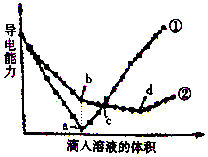 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 氧气和臭氧的混合物16 g中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com