
| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ①③ |
科目:高中化学 来源: 题型:选择题
| A. | NaX溶液的pH>7,则可证明HX属于弱电解质 | |
| B. | 二氯化铁溶液可以做电子工业中铜版的刻蚀液 | |
| C. | 实验室盛放NaF溶液不能用玻璃材质的试剂瓶及玻璃塞 | |
| D. | 浓的硫化钠溶液有强烈的臭味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
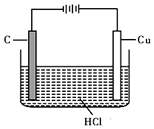 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L lmol•L-1 FeBr2溶液与l molCl2反应时转移的电子数目为3NA | |
| B. | 7g分子式为CnH2n的链烃中含有的C-H键的数目为NA | |
| C. | 常温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 0.5mol•L-1硫酸钠溶液中含有溶质离子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 滴加KI溶液时,CuI是还原产物,KI被还原 | |
| B. | 通入SO2后,溶液变无色,体现SO2的漂白性 | |
| C. | 整个过程发生了复分解反应和氧化还原反应 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Ksp均增大 | |
| C. | 25℃时pH=11的NaOH,当温度升高到80℃时,其pH不变 | |
| D. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明CH3COOH 是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{35}$Cl2与${\;}_{17}^{37}$Cl2氧化能力相近,二者互为同位素 | |
| B. | .过氧化氢的电子式: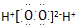 | |
| C. | .同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | .同周期主族元素原子半径随核电荷数的增大而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
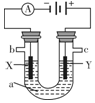 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com