
(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下:
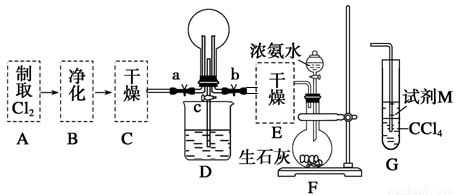
请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。A中反应物是KMnO4和浓盐酸,请写出A中发生反应的化学方程式: ,请写出试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是 。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为_________________________________________________________________。
(2)某废水中含有一定量的Na+、SO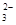 ,可能含有CO
,可能含有CO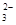 ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO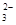 的浓度,设计如下实验方案:
的浓度,设计如下实验方案:

①从下列试剂中选择试剂X为_________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液 B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO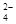 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;
③证明该废水中是否含有CO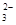 的实验方案为
。
的实验方案为
。
(1)①2KMnO4+16HCl(浓)=2MnCl2+2KCl + 5Cl2↑+8H2O (2分) FeI2 (1分)
先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色(2分)
②烧杯中的液体进入烧瓶中,形成喷泉(2分)
(2)①C(1分)
②Cl2+SO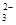 +H2O=2Cl+SO
+H2O=2Cl+SO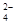 +2H+;(2分)
+2H+;(2分)
③向废水中加入足量的盐酸,将生成的气体先通入足量的酸性KMnO4溶液,再通入澄清石灰水,若紫色酸性KMnO4溶液颜色变浅,石灰水变浑浊,则证明废水中含有CO2 (2分)
【解析】
试题分析:(1)①KMnO4把HCl氧化为Cl2,化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl + 5Cl2↑+8H2O;②用一个化学反应判断出Cl2、Fe3+、I2的氧化性强弱,根据氧化剂的氧化性大于氧化产物的氧化性,加入碘化亚铁溶液,氯气先把碘离子氧化成碘单质,再把二价铁离子氧化成三价铁离子,所以看到的现象是:先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色。
②烧瓶内气体反应后压强减小,烧瓶内外导致产生压强差,所以烧杯中的水进入烧瓶产生喷泉。
(2)①亚硫酸根离子有还原性,能被强氧化剂氧化成硫酸根离子,所以要想使亚硫酸根离子生成硫酸根离子,应选择氧化性物质。A、虽然酸性高锰酸钾有强氧化性,但有硫酸根离子造成干扰,故A错误。B、氢氧化钠没有氧化性,故B错误。C、氯水有强氧化性,且不造成干扰,故C正确。D、碘化钾有还原性没有氧化性,故D错误。
②氯气有氧化性,亚硫酸根离子有还原性,所以亚硫酸根离子和氯气能发生氧化还原反应生成氯离子、硫酸根离子和氢离子Cl2+SO32-+H2O=2Cl-+SO42-+2 H+.
③二氧化硫和二氧化碳都能使澄清的石灰水变浑浊,但二氧化硫具有还原性,能使酸性高锰酸钾褪色,要想检验、碳酸根离子,首先要排除亚硫酸根离子的干扰,再将气体通入澄清的石灰水,若石灰水变浑浊,则证明废水中含有CO32-,否则没有。
考点:本题考查


科目:高中化学 来源: 题型:阅读理解
| 实验序号 | FeSO4溶液的体积读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 16.20 |
| 2 | 0.30 | 15.31 |
| 3 | 0.20 | 15.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com