
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| B. | 将Fe(NO3)2样品溶于稀盐酸中,然后滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已氧化变质 | |
| C. | 在食盐试样中加入盐酸和KI溶液,加入淀粉溶液后变蓝,说明食盐试样中可能含有KIO3 | |
| D. | 加入AgNO3溶液后生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在 |
分析 A.焰色反应为元素的性质;
B.Fe(NO3)2样品溶于稀盐酸中,发生氧化还原反应生成铁离子;
C.加入淀粉溶液后变蓝,可知发生氧化还原反应生成碘;
D.白色沉淀可能为硫酸银.
解答 解:A.焰色反应为元素的性质,则火焰呈黄色,该溶液可能是钠盐溶液或NaOH溶液,故A错误;
B.Fe(NO3)2样品溶于稀盐酸中,发生氧化还原反应生成铁离子,干扰检验,应溶于水,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已氧化变质,故B错误;
C.加入淀粉溶液后变蓝,可知发生氧化还原反应生成碘,则食盐试样中可能含有KIO3,故C正确;
D.白色沉淀,加稀盐酸沉淀不溶解时,白色沉淀可能为硫酸银,不能确定含Cl-,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握焰色反应、氧化还原反应、离子检验、实验技能为解本题关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:实验题
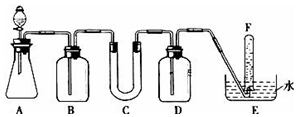 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl |
| C | 石棉绒与过氧化钠 | 与CO2反应,产生O2 |
| D | NaOH溶液 | 吸收未反应的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②①③④ | C. | ①③②④ | D. | ②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ Cl- NO3- H+ | B. | Na+ Cu2+ Cl- S2- | ||
| C. | K+ SO32- Fe3+ NO3- | D. | K+ Al3+ HCO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都能与铜较快反应 | |
| B. | 和铜反应中都表现出强氧化性和强酸性 | |
| C. | 都可以储存于铝制槽罐中 | |
| D. | 分别露置在空气中,容器内溶质的物质的量浓度都降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++H++CO32- | B. | Na2SO4=Na2++SO42- | ||
| C. | H2SO4=2H++SO42- | D. | KClO3=K++Cl-+3O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ③⑤②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com