
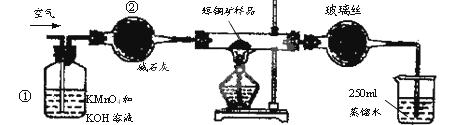
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A.连接好仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2 SO2 +2Cu。
SO2 +2Cu。
F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
| 滴定 次数 | 待测溶液的[来源:Z.X.X.K] 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) = 1 . 0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
下列事故处理方法正确的是( )
A.汽油失火时,立即用水灭火
B.实验室不小心碰翻酒精灯引起实验桌上的少量酒精起火时,迅速用泡沫灭火器灭火
C.浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D.浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|
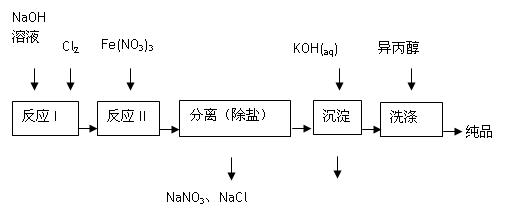

①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应I的化学方程式为 。
③反应II的离子方程式为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH= 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某有机物C6H12O2能发生水解反应生成A和B,B能氧化成C。若A、C都能发生银镜反应,则C6H12O2符合条件的结构简式有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
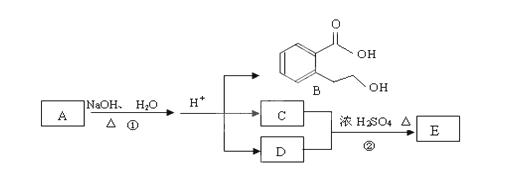
根据上图回答问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,C分子中的官能团名称是 ______________;化合物B不能发生的反应是(填字母序号):______________
a.加成反应 b.取代反应 c.消去反应
d.酯化反应 e.水解反应 f.置换反应
(2)反应②的化学方程式是__________________。
(3)反应②实验中加热的目的是: .。
(4)A的结构简式是 __________________。
(5)写出同时符合下列三个条件的B的同分异构体所有同分异构体的结构简式。
Ⅰ.含有间二取代苯环结构
Ⅱ.不属于芳香酸形成的酯
Ⅲ.与 FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W 属于同周期的短周期主族元素,原子序数依次增大,它们的原子最外层电子数之和为17,且Y原子最外层电子数是X原子最外层电子数的3倍,W的内层电子数比最外层电子数多。下列说法正确的是
A.原子半径大小:r(X)>r(Y);简单离子半径大小:r(W)>r(Z)
B.X、Y、Z最高价氧化物的水化物两两之间可以发生反应
C.氢化物的稳定性:W>Z;氧化物水化物的酸性:W>Z
D.甲物质由Y和Z元素组成,溶于水后得到甲的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
通过实验观察,某气体有下列性质:①有刺激性气味;②可使品红溶液褪色;③溶于水其水溶液可使石蕊试液变红;④通入浓硝酸中有红棕色气体产生;⑤可使溴水褪色。据此推测该气体可能是
A.HCl B.NH3 C.Cl2 D.SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com