

(2)足量的Fe粉与一定量的盐酸反应,反应速率太快,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的___________。
A.水 B.NaCl(固) C.NaCl溶液 D.Na2SO4溶液
E.NaNO3溶液 F.NaOH溶液 G.Na2CO3溶液 H.NaAc溶液
I.CuSO4溶液
解析:(1) ①t1→t2的速率变化主要原因:Mg与HCl反应放出的热量,使温度升高,导致总反应速率增大;②t2→t3速率变化主要原因:随反应进行,到一定时候,c(H+)降低显著,使总反应速率减小。
(2)A、C、D加入的物质均可起到稀释作用,NaCl(固)无此作用;而NaNO3溶液加入后,存在H+、![]() ,与Fe反应无H2,故必须考虑HNO3的强氧化性。从而必须注意:并非所有的强酸强碱盐溶液都合适。另外,HCl与F、G、H中溶质均反应:
,与Fe反应无H2,故必须考虑HNO3的强氧化性。从而必须注意:并非所有的强酸强碱盐溶液都合适。另外,HCl与F、G、H中溶质均反应:
HCl+NaOH![]() NaCl+H2O
NaCl+H2O
2HCl+Na2CO3![]() 2NaCl+H2O+CO2↑
2NaCl+H2O+CO2↑
HCl+CH3COONa![]() NaCl+CH3COOH
NaCl+CH3COOH
由三个反应可知,NaOH、Na2CO3与HCl反应使H+→H2O,而常温下Fe不跟H2O反应,无H2放出;NaAc与HCl反应生成了弱酸CH3COOH,但常温下Fe仍能与CH3COOH反应,速率减小,但H2量不变,即2HCl—2CH3COOH—H2,故HCl经反应必须能生成稳定的弱酸才可行。有CuSO4的加入,与Fe发生反应生成Cu附在Fe上,插在溶液中构成了无数微电池,大大加快反应速率。但因Fe足量,HCl量一定,故H2总量不变。
答案:(1)①Mg与HCl反应放出的热量,使温度升高,导致总反应速率增大 ②随反应进行,到一定时候,c(H+)降低显著,使总反应速率减小。(2)ACDH


科目:高中化学 来源: 题型:
 (1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为
(1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为 2Z
2Z 2Z
2Z查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:043
(1)把除去氧化膜的镁条投入到盛有盐酸的试管中,测得产生氢气的速率变化如图所示.
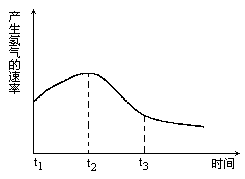
试说明在t1~t2时间内反应速率变化原因是________,t2~t3时间内,反应速率变化的原因是________.
(2)下图中,A是一种正盐,D的式量比C的式量大16,E是一种酸,当X无论是强酸还是强碱时都有如下转化关系:
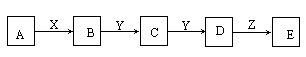
当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均同时含有另一种元素.
①A是________;Y是________;Z是________;
②当X是强酸时,E是________;当X是强碱时,E是________;
③写出A与X反应的化学方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
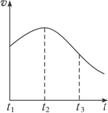
图2-8
(1)其中t1—t2化学反应速率变化的主要原因是___________________________________。
(2)t2—t3化学反应速率变化的主要原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com