
【题目】某种钢闸门保护法原理示意图如下,下列说法不正确的是
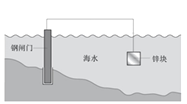
A. 锌块发生氧化反应:Zn-2e–= Zn2+
B. 钢闸门有电子流入,可以有效减缓腐蚀
C. 若通过外加电源保护钢闸门,应将钢闸门与电源正极相连
D. 锅炉内壁装上若干镁合金的防腐原理与该种钢闸门保护法原理相同
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应H2(g)+I2(g)![]() 2HI(g)达到平衡状态时的标志是( )
2HI(g)达到平衡状态时的标志是( )
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(—种固体催化剂)合成NH3的原理示意图如图。下列说法不正确的是
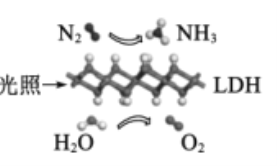
A.该过程将太阳能转化成为化学能
B.氧化剂与还原剂的物质的量之比为1:3
C.该过程中,涉及离子键和共价键的断裂与生成
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的结构简式如图所示。下列有关化合物X的说法正确的是
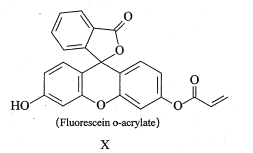
A.分子中3个苯环处于同一平面
B.分子中只有1个手性碳原子
C.1molX最多能与lmolBr2反应
D.1molX 与NaOH溶液反应时最多消耗4molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,用排饱和食盐水法先后收集20mL甲烷和80mL氯气,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。回答下列问题:
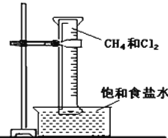
(1)大约30min后,可以观察到量筒内壁出现___________状液体,量筒内液面___________(填“上升”、“下降”或“不变”)。
(2)使1mol甲烷和氯气发生取代反应,生成相同物质的量的四种有机取代物,则需要氯气的物质的量是___________,写出其中常作为有机溶剂和灭火剂的物质的电子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用磷铁渣(含Fe、FeP、Fe2P及少量杂质)制备FePO4·2H2O(磷酸铁)的工艺流程如下:
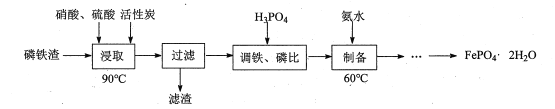
(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为__________。
②加入硫酸的目的是__________;加入活性炭能降低有害气体的产生,这是因为__________。
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是__________
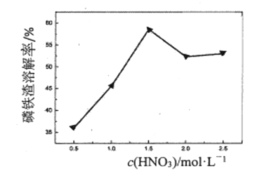 图-1
图-1
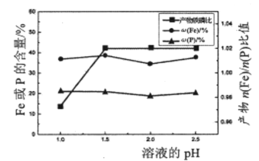 图-2
图-2
(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是___________;写出生成FePO4·2H2O的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其合金可用作材料、铝热剂等,在环境修复等方面也有着巨大的应用潜力。
(1)铝的冶炼、提纯的方法很多。
①高温碳热歧化氯化法冶铝包含的反应之一为:Al2O3(s)+AlCl3(g)+3C(s)![]() 3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
②碳热还原Al2O3冶铝的部分反应如下:
Ⅰ.2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1=akJ/mol
Ⅱ. 4Al2O3(s)+Al4C3(s)=3Al4O4C(s) △H2=bkJ/mol
Ⅲ. Al4O4C(s)+Al4C3(s)=8Al(g)+4CO(g) △H3=ckJ/mol
反应Al2O3(s)+3C(s)=2Al(g)+3CO(g)的△H=__________kJ/mol
③用离子液体AICb-BMIC(阳离子为EMIM+、阴离子为AlCl4-、Al2Cl7-)作电解质,可实现电解精炼铝。粗铝与外电源的_____________极(填“正”或“负")相连;工作时,阴极的电极反应式为_______________。
(2)真空条件及1173K时,可用铝热还原Li5AlO4制备金属锂(气态),写出该反应的化学方程式:__________________________。
(3)用Al、Fe或Al-Fe合金还原脱除水体中的硝态氮(NO3--N),在45℃,起始c(KNO3-N)为50mg·L-1、维持溶液呈中性并通入Ar等条件下进行脱除实验。结果如图所示(c0为起始浓度、c为剩余浓度):
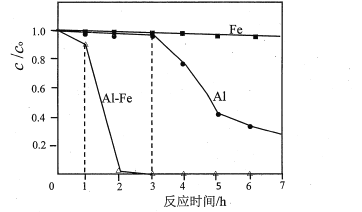
①纯Al在0~3h时,NO3-几乎没有被脱除,其原因是_______________________;写出3h后NO3-被还原为N2的离子方程式:____________________________。
②Al-Fe合金1~2h比纯A13~4h的脱除速率快得多的可能原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )

A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A. 有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B. 工业上通过电解氯化钠溶液制备金属钠和氯气
C. 室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com