
方法一:________________________________________。
方法二:________________________________________。
方法三:________________________________________。
方法四:________________________________________。
若制得相同质量的氧气,上述各反应中电子转移数目之比依次比为______________。
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:阅读理解
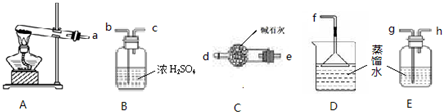
| ||
| ||
| 催化剂 |
| 高温高压 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
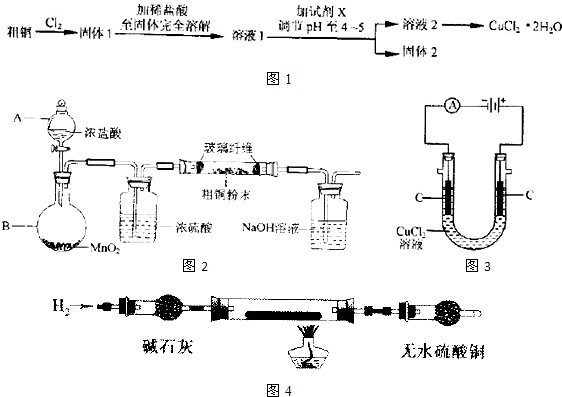
| ||
| ||
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

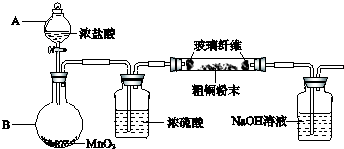
| ||
| ||
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)c(Cu
| ||
c[Cu
|
c(Cu
| ||
c[Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Fe2O3 | CO | Fe | CO2 | |
| 甲 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品于烧杯中加适量稀硫酸溶解 | \ |
| 步骤2: 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 |
若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3: 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 |
若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
| 步骤4: 空 空 |
空 空 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
| c(CuCl 42- ) |
| c[Cu(H2O) 42+ ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42+ ]?c4(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com