
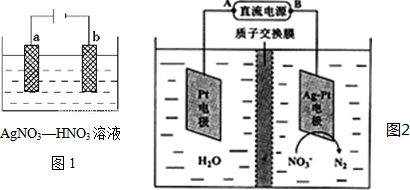
分析 (1)b电极上硝酸根离子得电子发生还原反应生成NO或NO2;
(2)①根据Cr原子守恒知,当生成1mol Cr(OH)3时,消耗1molCr3+,生成1molCr3+,消耗3molFe2+,生成3molFe2+转移6mol电子;
②阳极生成的Fe2+被溶液中的Cr2O72-氧化Fe3+,阴极H+放电,同时生成OH-;
(3)①根据图知,硝酸根离子得电子发生还原反应生成氮气,为阴极,阴极连接电源负极;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,得到膜两侧电解液的质量变化差.
解答 解:(1)b电极上生成红棕色气体,说明b电极上硝酸根离子得电子发生还原反应生成NO或NO2,生成的NO被氧气氧化生成二氧化氮,电极反应式为NO3-+3e-+4H+=NO↑+2H2O或NO3-+e-+2H+=NO2↑+H2O,
故答案为:NO3-+3e-+4H+=NO↑+2H2O或NO3-+e-+2H+=NO2↑+H2O;
(2)①根据Cr原子守恒知,当生成1mol Cr(OH)3时,消耗1molCr3+,生成1molCr3+,消耗3molFe2+,生成3molFe2+转移6mol电子,故答案为:6;
②阳极生成的Fe2+被溶液中的Cr2O72-氧化Fe3+,阴极H+放电,同时生成OH-,随着溶液中的酸性下降,使Fe3+的水解平衡右移,生成Fe(OH)3沉淀,
故答案为:阳极生成的Fe2+被溶液中的Cr2O72-氧化Fe3+,阴极H+放电,随着溶液中的酸性下降,使Fe3+的水解平衡右移,生成Fe(OH)3沉淀;
(3)①根据图知,硝酸根离子得电子发生还原反应生成氮气,为阴极,阴极连接电源负极,所以B为负极,则A为正极,故答案为:A;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g;
故答案为:14.4.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,明确各个电极上发生的反应、物质之间的转化是解本题关键,难点是(3)②的计算,易漏掉阴极室进入的氢离子而导致错误,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑥⑦ | B. | ③④⑥ | C. | ④⑥⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和甲酸甲酯 | B. | 乙烷和乙醛 | ||
| C. | 甲醛和麦芽糖(C12H22O11) | D. | 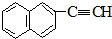 和 和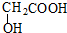 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H是离子化合物,含有离子键和共价键 | |
| B. | NH4H与水反应时,NH4H是还原剂 | |
| C. | NH4H投入少量的水中,有两种气体产生 | |
| D. | NH4H溶于水,所形成的溶液成酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.0mol•L-1 | B. | 16.0 mol•L-1 | C. | 12.4mol•L-1 | D. | 18.7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com