
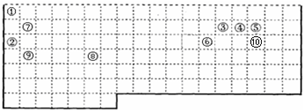
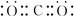
 ,该电子排布图错误的理由是违背了洪特规则.
,该电子排布图错误的理由是违背了洪特规则. 分析 (1)上边界为短周期元素,一周期有2种元素,位于1、18列,二、三周期有8种元素,位于1、2列及13~18列;最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属性元素;
(2)由元素的位置可知,⑩为S,最外层电子数为6;
(3)⑧为Cr,原子序数为24;
(4)③和⑤形成的原子个数比为1:2的分子为CO2;
(5)金属性越强,第一电离能越小,非金属性越强,电负性越大;
(6)元素⑥和元素⑦的氢氧化物有相似的性质.则元素⑦的氢氧化物与NaOH溶液反应生成偏铍酸钠、水;
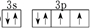
(7)2p电子应优先单独占据一个轨道.
解答 解:(1)上边界为短周期元素,一周期有2种元素,位于1、18列,二、三周期有8种元素,位于1、2列及13~18列;最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属性元素,补全元素周期表的边界,并画出金属与非金属的分界线为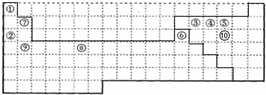 ,
,
故答案为: ;
;
(2)由元素的位置可知,⑩为S,最外层电子数为6,基态原子的最外层电子的电子排布图为 ,故答案为:
,故答案为: ;
;
(3)⑧为Cr,原子序数为24,原子的核外电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(4)③和⑤形成的原子个数比为1:2的分子为CO2,电子式为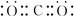 ,故答案为:
,故答案为: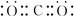 ;
;
(5)金属性越强,第一电离能越小,非金属性越强,电负性越大,则③④⑤⑦四种元素位于第二周期,且N的2p电子半满为稳定结构,它们原子的第一电离能由小到大的顺序是Be<C<O<N;它们的电负性由低到高的顺序是Be<C<N<O,
故答案为:Be<C<O<N;Be<C<N<O;
(6)元素⑥和元素⑦的氢氧化物有相似的性质.则元素⑦的氢氧化物与NaOH溶液反应生成偏铍酸钠、水,反应为Be(OH)2+2NaOH=Na2BeO2+2H2O,
故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O;
(7)2p电子应优先单独占据一个轨道,则 中电子排布图错误的理由是违背了洪特规则,故答案为:违背了洪特规则.
中电子排布图错误的理由是违背了洪特规则,故答案为:违背了洪特规则.
点评 本题考查元素的位置、结构与性质,为高频考点,把握周期表的结构、原子结构及电子排布等为解答的关键,综合性较强,侧重分析与应用能力的考查,题目难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 暖冰中水分子是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 暖冰中水分子的各原子均满足8电子稳定结构 | |
| C. | 水凝固形成20℃时的“暖冰”所发生的变化是化学变化 | |
| D. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:PH3<NH3<H2O | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 酸性:H2CO3<HClO<HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子总是先排布在能量最低的电子层里 | |
| B. | 每个电子层最多能容纳的电子数为2n2 | |
| C. | 最外层电子数不超过8个(K为最外层时不超过2个) | |
| D. | S2-的M层电子数是K层电子数的3倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定、pH试纸 | B. | 蒸馏、Na2CO3溶液 | ||
| C. | 电解、NaOH溶液 | D. | 酯化反应、石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的有机物都可以燃烧 | |
| B. | 一定条件下,甲烷、苯、乙酸、乙醇、油脂都可以发生取代反应 | |
| C. | 糖类、油脂都属于高分子化合物 | |
| D. | 石油的分馏、裂化、裂解和煤的干馏都属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
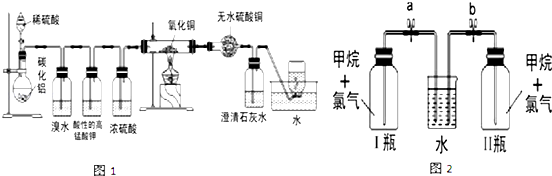
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
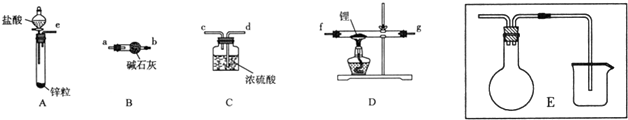
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com