
| A. | 上述反应中金属共失去电子0.1mol | |
| B. | 合金中,铜的质量为2.8g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5mol•L-1的NaOH溶液60mL |
分析 n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则转移电子为0.1mol×(5-2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,结合选项分析.
解答 解:n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则转移电子为0.1mol×(5-2)=0.3mol,反应后溶液中的c(H+)=0.5mol/L,则反应后剩余n(HNO3)=0.5mol/L×0.1L=0.05mol,设合金中Cu为xmol,Fe为ymol,由电子守恒可知:2x+3y=0.3mol,由合金的质量可知:64x+56y=7.6,解得x=0.075mol,y=0.05mol,
A.由分析可知,金属共失去电子0.3 mol,故A错误;
B.合金中,铜的质量为0.075mol×64=4.8 g,故B错误;
C.反应生成Cu(NO3)2、Fe(NO3)3和NO,以及剩余的硝酸,根据氮原子守恒可知,n(HNO3)=0.075×2+0.05×3+0.1+0.05=0.45mol,则c(HNO3)=$\frac{n}{V}$=$\frac{0.45mol}{0.1L}$=4.5mol/L,故C正确;
D.要使溶液中的金属离子完全沉淀,溶液中的溶质为NaNO3,n(NaNO3)=n(NaOH)=0.075×2+0.05×3+0.05=0.35mol,V=$\frac{n}{c}$=$\frac{0.35mol}{5mol/L}$=0.07L=70mL,故D错误.
故选C.
点评 本题主要考查混合物有关计算,涉及铁铜与硝酸反应、生成的盐与氢氧化钠反应,侧重于学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力的考查,是一道考查能力的好题,难度中等.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | V1=V2 | B. | V1>V2 | C. | V1<V2 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
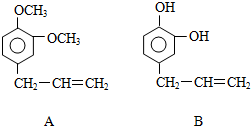
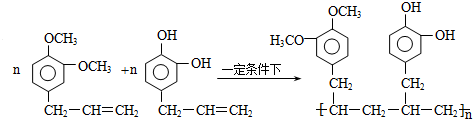 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
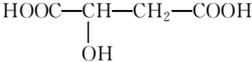
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;2 Na+2 H2O═2 NaOH+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | |
| C. | FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2+O2+H2O═2 Fe(OH)3 | |
| D. | 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应达到化学平衡状态的正逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等 | |
| B. | 标准状况下,1 L辛烷完全燃烧生成CO2 8 L | |
| C. | 2.4 g Mg无论与O2还是与N2完全反应,转移电子数都是0.2NA | |
| D. | 1 L 1 mol•L-1 CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯硅用于制造光导纤维,实现光电信号转化 | |
| B. | 石英中无色透明的晶体就是通常所说的水晶,其主要成分是二氧化硅 | |
| C. | 光导纤维导光的能力很强,是非常好的通讯材料 | |
| D. | 硅胶多孔,吸附水能力强,可以用作催化剂的载体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com