
 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
 H2O(g)+CO(g)
H2O(g)+CO(g)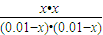 =
= ,解得x=0.006
,解得x=0.006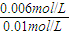 ×100%=60%,恒温恒容下,乙中氢气的起始浓度比甲中氢气的起始浓度大,故乙中二氧化碳的转化率比甲中高,故平衡时,乙中CO2的转化率大于60%,故A正确;
×100%=60%,恒温恒容下,乙中氢气的起始浓度比甲中氢气的起始浓度大,故乙中二氧化碳的转化率比甲中高,故平衡时,乙中CO2的转化率大于60%,故A正确;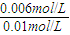 ×100%=60%,故甲中和丙中H2的转化率均为60%,故B正确;
×100%=60%,故甲中和丙中H2的转化率均为60%,故B正确;

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K= H2O(g)+CO(g)的平衡常数K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
(2010?北京)某温度下,H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| 9 |
| 4 |
| 起始浓度(mol/L) | 甲 | 乙 | 丙 | 丁 |
| c(H2) | 0.01 | 0.02 | 0.02 | 0.005 |
| c(CO2) | 0.01 | 0.01 | 0.02 | 0.005 |
| c(H2O) | 0 | 0 | 0 | 0.005 |
| c(CO) | 0 | 0 | 0 | 0.005 |
| A、平衡时,乙中CO2的转化率>60% | ||
B、平衡时,四容器中甲的
| ||
| C、起始时丁向正反应方向进行 | ||
| D、反应开始时,丙中反应速率最快 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省丹东市四校协作体第二次联考高三化学试卷 题型:选择题
某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是( )
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是( )

A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源:2010年高考试题--化学(北京卷)解析 题型:单选题
 某温度下,H2(g)+CO2(g)
某温度下,H2(g)+CO2(g)
 H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com