
| A、氧化剂 | B、被还原 |
| C、还原剂 | D、氧化产物 |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 | H2O | 0.01mol?L-1 X 溶液 | 0.1 mol?L-1 双氧水 | 1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2C2O4在反应中被还原 |
| B、ClO2是氧化产物 |
| C、KClO3 在反应中得到电子 |
| D、1 mol KClO3 参加反应有 2 mol 电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
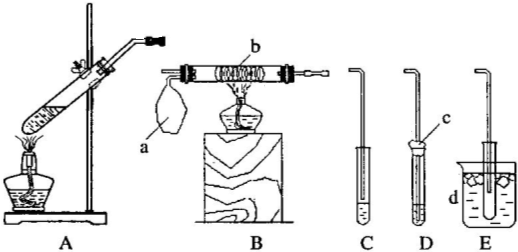
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验现象(填入下栏) |
如右图,在一个100ml烧杯中,加入3~4药匙Na2CO3,粉末,用一张比烧杯口稍大,中部呈凹形的铁丝网,凹部放入疏松的脱脂棉包裹着的过氧化钠,向烧杯中加入适量3mol?L-1盐酸,立即把铁丝网放在烧杯上.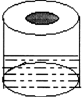 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 |
| B、用萃取的方法分离汽油和煤油 |
| C、用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 |
| D、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.05 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.10 mol?L-1 |
| D、0.50 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com