
| A. | W、X形成的化合物只含有离子键 | B. | 原子半径:Y>Z>W | ||
| C. | 还原性:W2->Y2- | D. | 氧化物的水化物酸性:Y<Z |
分析 短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na元素;W2-和X+的电子层结构相同,则W为O元素;W与Y同族,则Y为S元素;Z为短周期元素,其原子序数大于S,则Z为Cl元素,据此进行解答.
解答 解:短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na元素;W2-和X+的电子层结构相同,则W为O元素;W与Y同族,则Y为S元素;Z为短周期元素,其原子序数大于S,则Z为Cl元素,
A.W、X分别为O、Na元素,形成的化合物有氧化钠和过氧化钠,过氧化钠中除了含有离子键还含有共价键,故A错误;
B.电子层越多,原子半径越大,电子层相同时,核电荷数越大原子半径越小,则原子半径Y>Z>W,故B正确;
C.非金属性越强,对应离子的还原性越弱,非金属性:O>S,则离子的还原性:W2-<Y2-,故C错误;
D.没有指出最高价氧化物对应水合物的酸性,无法比较二者酸性,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的关系,为高频考点,把握元素的位置、性质、原子结构推断元素为解答的关键,注意规律性知识的应用,确定Z为Cl为解答的难点,题目难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 自然界中氮、钠、硅元素均可以游离态形式存在 | |
| B. | 将反应后的固体溶于适量水,静置,通入CO2,无现象 | |
| C. | 微粒的半径:r(K+)>r(Na+)>r(O2-) | |
| D. | 若反应中转移6.02×1022电子,则消耗NaN3的质量为6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.
在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
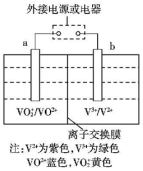
| A. | 放电时,a极是电池的负极 | |
| B. | 充电时,a极的电极反应式为:VO2++2H++e-═VO2++H2O | |
| C. | 氧化性VO2+>V3+ | |
| D. | 放电时,H+从左槽迁移进右槽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.8g正丁烷与异丁烷组成的混合气体中含有的C-H键数目为NA | |
| B. | 1mol的CO2和水蒸气的混合气体与过量Na2O2充分反应转移的电子数为2NA | |
| C. | 将0.2molNH3充入密闭容器中在一定条件下加热分解,生成N2的分子数为0.1NA | |
| D. | 相同温度下50mL0.1mol•L-1CH3COOH溶液和10mL0.5mol•L-1CH3COOH溶液中所含CH3COOH分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C |
| D |
| A. | 原子半径由大到小的顺序为E>B>D>C>A | |
| B. | 元素D可形成多种酸,它们的酸根均能促进水的电离 | |
| C. | EB2中存在离子键与非极性共价键 | |
| D. | C位于周期表中第二周期第ⅦA族,其最高正价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过向阳极移动 | |
| B. | 交换膜Ⅱ为阴离子交换膜,H+从浓缩室通过向阴极移动 | |
| C. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| D. | 400mL0.1mol•L-1乳酸溶液通电一段时间后,浓度上升到0.6mol•L-1,则阴极上产生的H2在标准状况下的体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3 | |
| B. | 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2 | |
| C. | 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3 | |
| D. | 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子从b流出,经外电路流向a | |
| B. | HS在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-═SO42-+9H+ | |
| C. | 如果将反应物直接燃烧,能量的利用率不会变化 | |
| D. | 若该电池电路中有0.4mol电子发生转移,则有0.5mol H+通过质子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com