
| A、砹化氢(HAt)很稳定 |
| B、单质砹易溶于某些有机溶剂 |
| C、砹比碘的原子半径大 |
| D、单质砹是有色固体 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、H3BO3的酸性比H2CO3的强 |
| B、Mg(OH)2的碱性比Be(OH)2的强 |
| C、HCl、HBr、HI的热稳定性依次增强 |
| D、若M+和R2-的核外电子层结构相同,则离子半径:M+>R2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.9mol/L |
| B、0.45m01/L |
| C、0.25mol/L |
| D、0.225mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如图.
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如图.| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图1所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| B、用图2所示装置除去CO2中含有的少量HCl |
| C、用图3所示装置制取并收集干燥纯净的NH3 |
| D、用图4所示装置吸收氨气并防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

283 116 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、放电时的负极反应为Li-e-=Li+ |
| B、若用该电池电解水,阴极生成3.52gO2,则该电池负极质量减少0.77g |
| C、锂离子电池充电时的阴极反应为Si+4.4e-+4.4Li+=Li4.4Si |
| D、放电时电解质LiPF6水溶液中的Li+移向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
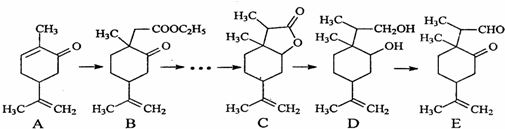
| CH3I |
| 催化剂 |
| LiBH4 |
| THF |
| LiBH4 |
| THF |
| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com